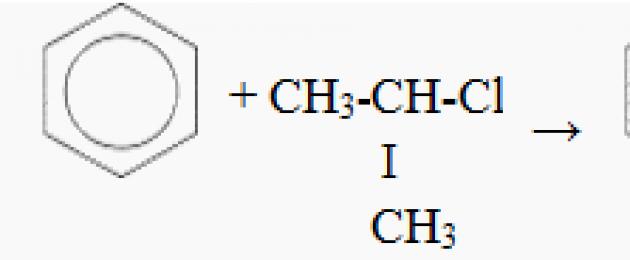DEFINICE
Benzen- je to bezbarvá kapalina s charakteristickým zápachem; bod varu 80,1 o C, bod tání 5,5 o C. Nerozpustný ve vodě, toxický.
Aromatické vlastnosti benzenu, určené zvláštnostmi jeho struktury, jsou vyjádřeny v relativní stabilitě benzenového kruhu, navzdory nenasycenému složení benzenu. Na rozdíl od nenasycených sloučenin s ethylenovými dvojnými vazbami je tedy benzen odolný vůči oxidačním činidlům.
Rýže. 1. Struktura molekuly benzenu podle Kekula.
Získání benzenu
Mezi hlavní způsoby získávání benzenu patří:
— dehydrocyklizace hexanu (katalyzátory - Pt, Cr 3 O 2)
CH3-(CH2)4-CH3 -> C6H6 + 4H2 (to C, p, kat = Cr203);
— dehydrogenaci cyklohexanu
C6H12 -> C6H6 + 3H2 (to C, kat = Pt, Ni);
— trimerace acetylenu (reakce probíhá při zahřátí na 600 o C, katalyzátorem je aktivní uhlí)
3HC≡CH -> C6H6 (t = 600 °C, kat = C aktivní).
Chemické vlastnosti benzenu
Benzen je charakterizován substitučními reakcemi, které probíhají elektrofilním mechanismem:
Halogenace (benzen reaguje s chlorem a bromem za přítomnosti katalyzátorů - bezvodý AlCl 3, FeCl 3, AlBr 3)
C6H6 + Cl2 = C6H5-Cl + HCl;
- nitrace (benzen snadno reaguje s nitrační směsí - směs koncentrované kyseliny dusičné a sírové)

- alkylace alkeny
C6H6 + CH2=CH-CH3 → C6H5-CH(CH3)2
Adiční reakce na benzen vedou ke zničení aromatického systému a vyskytují se pouze za drsných podmínek:
- hydrogenace (produkt reakce - cyklohexan)
C6H6 + 3H2 -> C6H12 (to C, kat = Pt);
- přídavek chlóru (dochází vlivem UV záření za vzniku pevného produktu - hexachlorcyklohexan (hexachloran) - C 6 H 6 Cl 6)
C6H6 + 6Cl2 -> C6H6CI6.
Aplikace benzenu
Benzen je široce používán v průmyslové organické chemii. Téměř všechny sloučeniny obsahující benzenové kruhy se získávají z benzenu, například styren, fenol, anilin, halogenované areny. Benzen se používá pro syntézu barviv, povrchově aktivních látek a léčiv.
Příklady řešení problémů
PŘÍKLAD 1
| Cvičení | Hustota par látky je 3,482 g/l. Jeho pyrolýzou bylo získáno 6 g sazí a 5,6 litru vodíku. Určete vzorec této látky. |
| Řešení | Saze jsou uhlík. Zjistime množství sazí na základě podmínek úlohy (molární hmotnost uhlíku je 12 g/mol): n(C) = m(C)/M(C); n(C) = 6/12 = 0,5 mol. Vypočítejme množství vodíkové látky: n(H2) = V(H2)/Vm; n(H2) = 5,6 / 22,4 = 0,25 mol. To znamená, že látkové množství jednoho atomu vodíku se bude rovnat: n(H) = 2 x 0,25 = 0,5 mol. Označme počet atomů uhlíku v molekule uhlovodíku jako „x“ a počet atomů vodíku jako „y“, pak poměr těchto atomů v molekule je: x: y = 0,5: 0,5 = 1:1. Pak bude nejjednodušší uhlovodíkový vzorec vyjádřen složením CH. Molekulová hmotnost molekuly složení CH je rovna: M(CH) = 13 g/mol Pojďme najít molekulovou hmotnost uhlovodíku na základě podmínek problému: M (CxHy) = pxVm; M (CxHy) = 3,482 x 22,4 = 78 g/mol. Pojďme určit skutečný vzorec uhlovodíku: k= M(CxHy)/M(CH)= 78/13=6, proto je třeba koeficienty „x“ a „y“ vynásobit 6 a potom uhlovodíkový vzorec bude mít tvar C6H6. Toto je benzen. |
| Odpověď | Požadovaný uhlovodík má složení C6H6. Toto je benzen. |
PŘÍKLAD 2
| Cvičení | Vypočítejte množství acetylenové látky, které bude potřeba k získání 400 ml benzenu (hustota 0,8 g/ml). | |||||||||||
| Řešení | Napišme reakční rovnici pro výrobu benzenu z acetylenu: DEFINICE Benzen(cyklohexatrien - 1,3,5) je organická látka, nejjednodušší zástupce řady aromatických uhlovodíků. Vzorec – C 6 H 6 (strukturní vzorec – obr. 1). Molekulová hmotnost – 78,11. Rýže. 1. Strukturní a prostorové vzorce benzenu. Všech šest atomů uhlíku v molekule benzenu je v hybridním stavu sp2. Každý atom uhlíku tvoří 3σ vazby se dvěma dalšími atomy uhlíku a jedním atomem vodíku, které leží ve stejné rovině. Šest atomů uhlíku tvoří pravidelný šestiúhelník (σ-kostra molekuly benzenu). Každý atom uhlíku má jeden nehybridizovaný orbital p obsahující jeden elektron. Šest p-elektronů tvoří jediný π-elektronový oblak (aromatický systém), který je zobrazen jako kruh uvnitř šestičlenného prstence. Uhlovodíkový radikál získaný z benzenu se nazývá C 6 H 5 - - fenyl (Ph-). Chemické vlastnosti benzenuBenzen je charakterizován substitučními reakcemi, které probíhají elektrofilním mechanismem: - halogenace (benzen reaguje s chlorem a bromem za přítomnosti katalyzátorů - bezvodý AlCl 3, FeCl 3, AlBr 3) C6H6 + Cl2 = C6H5-Cl + HCl; - nitrace (benzen snadno reaguje s nitrační směsí - směs koncentrované kyseliny dusičné a sírové) - alkylace alkeny C6H6 + CH2 = CH-CH3 -> C6H5-CH(CH3)2; Adiční reakce na benzen vedou ke zničení aromatického systému a vyskytují se pouze za drsných podmínek: — hydrogenace (reakce probíhá při zahřátí, katalyzátorem je Pt) - přídavek chlóru (dochází vlivem UV záření za vzniku pevného produktu - hexachlorcyklohexan (hexachloran) - C 6 H 6 Cl 6) Jako každá organická sloučenina podléhá benzen spalovací reakci s tvorbou oxidu uhličitého a vody jako reakčních produktů (hoří kouřovým plamenem): 2C6H6+1502 -> 12C02 + 6H20. Fyzikální vlastnosti benzenuBenzen je bezbarvá kapalina, ale má specifický štiplavý zápach. S vodou tvoří azeotropní směs, dobře se mísí s ethery, benzínem a různými organickými rozpouštědly. Bod varu – 80,1C, bod tání – 5,5C. Toxický, karcinogenní (tj. podporuje rozvoj rakoviny). Příprava a použití benzenuHlavní způsoby získávání benzenu: — dehydrocyklizace hexanu (katalyzátory – Pt, Cr 3 O 2) CH3-(CH2)4-CH3 -> C6H6 + 4H2; — dehydrogenace cyklohexanu (reakce probíhá při zahřátí, katalyzátorem je Pt) C6H12 -> C6H6 + 4H2; — trimerizace acetylenu (reakce probíhá při zahřátí na 600C, katalyzátorem je aktivní uhlí) 3HC=CH -> C6H6. Benzen slouží jako surovina pro výrobu homologů (ethylbenzen, kumen), cyklohexanu, nitrobenzenu, chlorbenzenu a dalších látek. Dříve se benzen používal jako přísada do benzínu pro zvýšení jeho oktanového čísla, nyní je však obsah benzenu v palivu kvůli jeho vysoké toxicitě přísně regulován. Benzen se někdy používá jako rozpouštědlo. Příklady řešení problémůPŘÍKLAD 1
PŘÍKLAD 2
s čím benzen reaguje a jejich reakční rovnice
Cyklickou strukturu benzenu poprvé navrhl F.A. Kekule v roce 1865
Friedrich August Kekule von Stradonitz - vynikající německý chemik 19. století. V roce 1854 objevil první organickou sloučeninu obsahující síru – kyselinu thiooctovou (kyselinu thioethanovou). Kromě toho stanovil strukturu diazo sloučenin. Jeho nejznámějším příspěvkem k rozvoji chemie je však stanovení struktury benzenu (1866). Kekule ukázal, že se kolem prstence střídají dvojné vazby benzenu (tato myšlenka ho poprvé napadla ve snu). Později ukázal, že dvě možná uspořádání dvojné vazby jsou identická a že benzenový kruh je hybrid mezi těmito dvěma strukturami. Předvídal tedy myšlenku rezonance (mezomerismus), která se objevila v teorii chemických vazeb na počátku třicátých let. Pokud by benzen skutečně měl takovou strukturu, pak by jeho 1,2-disubstituované deriváty měly mít dva izomery. Například,
Žádný z 1,2-disubstituovaných benzenů však nelze izolovat na dva izomery. Kekule proto následně navrhl, že molekula benzenu existuje jako dvě struktury, které se rychle přeměňují jedna v druhou:
Všimněte si, že taková schematická znázornění molekul benzenu a jejich derivátů obvykle neoznačují atomy vodíku připojené k atomům uhlíku benzenového kruhu. V moderní chemii je molekula benzenu považována za rezonanční hybrid těchto dvou limitujících rezonančních forem (viz část 2.1). Další popis molekuly benzenu je založen na úvahách o jejích molekulárních orbitalech. V odd. 3.1 bylo naznačeno, že -elektrony umístěné v -vazebných orbitalech jsou delokalizovány mezi všemi atomy uhlíku benzenového kruhu a tvoří -elektronový mrak. V souladu s tímto znázorněním může být molekula benzenu konvenčně znázorněna následovně: Experimentální data potvrzují přítomnost právě takové struktury v benzenu. Pokud měl benzen strukturu, kterou původně navrhoval Kekulé, se třemi konjugovanými dvojnými vazbami, pak by benzen měl podléhat adičním reakcím jako alkeny. Jak je však uvedeno výše, benzen nepodléhá adičním reakcím. Navíc je benzen stabilnější, než kdyby měl tři izolované dvojné vazby. V odd. 5.3 bylo uvedeno, že entalpie hydrogenace benzenu za vzniku cyklohexanu má větší zápor Tabulka 18.3. Délka různých vazeb uhlík-uhlík
Rýže. 18.6. Geometrická struktura molekuly benzenu. hodnotu než trojnásobek entalpie hydrogenace cyklohexenu. Rozdíl mezi těmito veličinami se obvykle nazývá entalpie delokalizace, rezonanční energie nebo stabilizační energie benzenu. Všechny vazby uhlík-uhlík v benzenovém kruhu mají stejnou délku, která je kratší než délka vazeb C-C v alkanech, ale delší než délka vazeb C=C v alkenech (tab. 18.3). To potvrzuje, že vazby uhlík-uhlík v benzenu jsou hybridem mezi jednoduchými a dvojnými vazbami. Molekula benzenu má plochou strukturu, která je znázorněna na Obr. 18.6. Fyzikální vlastnostiBenzen je za normálních podmínek bezbarvá kapalina, která mrzne při 5,5 °C a vře při 80 °C. Má charakteristickou příjemnou vůni, ale jak bylo uvedeno výše, je vysoce toxický. Benzen se nemísí s vodou a v benzenovém systému tvoří voda horní ze dvou vrstev. Je však rozpustný v nepolárních organických rozpouštědlech a sám je dobrým rozpouštědlem pro jiné organické sloučeniny. Chemické vlastnostiAčkoli benzen podléhá určitým adičním reakcím (viz níže), nevykazuje reaktivitu typickou pro alkeny. Neodbarvuje například bromovou vodu nebo roztok -iontů. Navíc benzen není vstupuje do adičních reakcí se silnými kyselinami, jako je kyselina chlorovodíková nebo sírová. Současně se benzen účastní řady elektrofilních substitučních reakcí. Produkty tohoto typu reakce jsou aromatické sloučeniny, protože při těchto reakcích je zachován delokalizovaný elektronický systém benzenu. Obecný mechanismus pro nahrazení atomu vodíku na benzenovém kruhu elektrofilem je popsán v části. 17.3. Příklady elektrofilní substituce benzenu jsou jeho nitrace, halogenace, sulfonace a Friedel-Craftsovy reakce. Nitrace. Benzen lze nitrovat (přidat k němu skupinu) zpracováním se směsí koncentrované kyseliny dusičné a sírové:
Nitrobenzen Podmínky této reakce a její mechanismus jsou popsány v části. 17.3. Nitrobenzen je světle žlutá kapalina s charakteristickým mandlovým zápachem. Při nitraci benzenu vznikají kromě nitrobenzenu také krystaly 1,3-dinitrobenzenu, který je produktem následující reakce:
Halogenace. Pokud smícháte benzen s chlórem nebo bromem ve tmě, nedojde k žádné reakci. Avšak v přítomnosti katalyzátorů majících vlastnosti Lewisových kyselin dochází v takových směsích k elektrofilním substitučním reakcím. Typickými katalyzátory pro tyto reakce jsou bromid železitý a chlorid hlinitý. Účinek těchto katalyzátorů spočívá v tom, že vytvářejí polarizaci v molekulách halogenu, které pak tvoří komplex s katalyzátorem: ačkoli neexistuje žádný přímý důkaz, že v tomto případě vznikají volné ionty. Mechanismus bromace benzenu pomocí bromidu železitého jako iontového nosiče lze znázornit následovně:
Sulfonace. Benzen lze sulfonovat (nahradit atom vodíku sulfoskupinou) refluxováním jeho směsi s koncentrovanou kyselinou sírovou po dobu několika hodin. Místo toho lze benzen opatrně zahřívat ve směsi s dýmavou kyselinou sírovou. Dýmavá kyselina sírová obsahuje oxid sírový. Mechanismus této reakce lze znázornit diagramem
Friedel-Craftsovy reakce. Friedel-Craftsovy reakce byly původně nazývány kondenzační reakce mezi aromatickými sloučeninami a alkylhalogenidy v přítomnosti bezvodého katalyzátoru chloridu hlinitého. Při kondenzačních reakcích se dvě molekuly činidel (nebo jedno činidlo) vzájemně spojí a vytvoří molekulu nové sloučeniny, přičemž se z nich odštěpí (vyloučí) molekula nějaké jednoduché sloučeniny, jako je voda nebo chlorovodík. V současnosti se Friedel-Craftsova reakce nazývá jakákoli elektrofilní substituce aromatické sloučeniny, ve které roli elektrofilu hraje karbokation nebo vysoce polarizovaný komplex s kladně nabitým atomem uhlíku. Elektrofilním činidlem je zpravidla alkylhalogenid nebo chlorid některé karboxylové kyseliny, i když to může být také například alken nebo alkohol. Jako katalyzátor pro tyto reakce se obvykle používá bezvodý chlorid hlinitý. Friedel-Craftsovy reakce jsou obvykle rozděleny do dvou typů: alkylace a acylace. Alkylace. Při tomto typu Friedel-Craftsovy reakce je jeden nebo více atomů vodíku na benzenovém kruhu nahrazeno alkylovými skupinami. Například, když se směs benzenu a chlormethanu mírně zahřívá v přítomnosti bezvodého chloridu hlinitého, vytvoří se methylbenzen. Chlormethan hraje v této reakci roli elektrofilního činidla. Je polarizován chloridem hlinitým stejným způsobem jako u molekul halogenů: Mechanismus uvažované reakce lze představit takto:
Je třeba poznamenat, že při této kondenzační reakci mezi benzenem a chlormethanem je eliminována molekula chlorovodíku. Všimněte si také, že skutečná existence kovového karbokationtu ve formě volného iontu je pochybná. Alkylace benzenu chlormethanem v přítomnosti katalyzátoru - bezvodého chloridu hlinitého nevede ke vzniku methylbenzenu. V této reakci dochází k další alkylaci benzenového kruhu, což vede k tvorbě 1,2-dimethylbenzenu:
Acylace. Při tomto typu Friedel-Craftsovy reakce je atom vodíku na benzenovém kruhu nahrazen acylovou skupinou, což vede k vytvoření aromatického ketonu. Acylová skupina má obecný vzorec Systematický název acylové sloučeniny vzniká nahrazením přípony a koncovky -ova v názvu odpovídající karboxylové kyseliny, jejíž je tato acylová sloučenina derivátem, příponou -(o)yl. Například
Acylace benzenu se provádí za použití chloridu nebo anhydridu jakékoli karboxylové kyseliny v přítomnosti katalyzátoru, bezvodého chloridu hlinitého. Například
Tato reakce je kondenzací, při které je eliminována molekula chlorovodíku. Všimněte si také, že název „fenyl“ se často používá k označení benzenového kruhu ve sloučeninách, kde benzen není hlavní skupinou:
Adiční reakce. Ačkoli je benzen nejvíce charakterizován elektrofilními substitučními reakcemi, podléhá také některým adičním reakcím. S jedním z nich jsme se již setkali. Hovoříme o hydrogenaci benzenu (viz část 5.3). Při průchodu směsi benzenu a vodíku po povrchu jemně mletého niklového katalyzátoru při teplotě 150-160 °C dochází k celé řadě reakcí, které končí vznikem cyklohexanu. Celková stechiometrická rovnice pro tuto reakci může být reprezentována takto:
Při vystavení ultrafialovému záření nebo přímému slunečnímu záření reaguje benzen také s chlórem. Tato reakce probíhá složitým radikálovým mechanismem. Jeho konečným produktem je 1,2,3,4,5,6-hexachlorcyklohexan:
K podobné reakci dochází mezi benzenem a bromem pod vlivem ultrafialového záření nebo slunečního záření. Oxidace. Benzen a benzenový kruh v jiných aromatických sloučeninách jsou, obecně řečeno, odolné vůči oxidaci i tak silnými oxidačními činidly, jako je kyselý nebo alkalický roztok manganistanu draselného. Benzen a další aromatické sloučeniny však hoří na vzduchu nebo kyslíku za vzniku velmi kouřového plamene, což je typické pro uhlovodíky s vysokým relativním obsahem uhlíku. Benzenový kruh je poměrně stabilní. Je náchylnější k substitučním reakcím za atomy vodíku benzenového kruhu než k adičním reakcím v místě štěpení dvojné vazby. V tomto výrazu jeho "aromatický charakter". Substituční reakce Nejtypičtější reakce jsou elektrofilní substituce: nitrace, sulfonace, alkylace (acylace), halogenace (halogenace homologů benzenu může probíhat i radikálním mechanismem). 1. Nitrace- náhrada vodíku benzenového kruhu nitroskupinou se provádí tzv. nitrační směsí - směsí koncentrované kyseliny dusičné a sírové. Účinnou látkou je nitroniový kationt N02+: HO - N0 2 + 2H 2 S0 4 →N0 2 + + 2HS0 4 - + H 3 0 Nitroniový kation hydroniový kation Mechanismus nitrace (stejně jako všechny substituční reakce) je následující: Přítomnost vody v reakční směsi narušuje průběh reakce, protože voda se účastní procesu obráceného k tvorbě nitroniového kationtu. K navázání vody uvolněné při reakci se proto odebírá přebytek koncentrované kyseliny sírové. Pravidla pro nahrazení vodíků v benzenovém kruhu. Pokud je v benzenovém kruhu nějaký vodíkový substituent, pak v elektrofilních substitučních reakcích hraje roli orientátoru - reakce probíhá převážně v ortho- a para-poloze vzhledem k substituentu (orientant prvního řádu) nebo meta-polohách (orientant druhého druhu) . Náhradníci prvního druhu nasměrovat útočící elektrofil do orto- a para-polohy vzhledem k sobě. Uvádíme je v sestupném pořadí podle orientační síly (efekt elektrodonoru): Substituenty typu II směrují útočící elektrofil do meta poloh vzhledem k nim samotným. Uvádíme je také v sestupném pořadí podle orientační síly: Například -OH - skupina - orientant prvního druhu:
59. Napište rovnici a mechanismus nitračních reakcí následujících sloučenin: a) benzen; b) toluen; c) chlorbenzen; d) nitrobenzen; e) sulfobenzen; f) fenylkyanid; g) methoxybenzen; h) aminobenzen.
Substituenty prvního druhu jsou donory elektronů, zvyšují hustotu elektronového oblaku benzenového kruhu, zejména v orto- a para-poloze, a tím (usnadňují) aktivaci benzenového kruhu k útoku na elektrofil. σ-komplex (III) je však stabilizován nikoli přídavkem aniontu, ale eliminací vodíkového kationtu (energie uvolněná při tvorbě jediného π-elektronového oblaku benzenového kruhu je 36,6 kcal/mol ):
Substituenty druhého druhu jsou přitahující elektrony, zdá se, že přitahují část elektronového oblaku k sobě, čímž snižují hustotu elektronového oblaku benzenového kruhu, zejména v ortho a para polohách vůči sobě. Substituenty druhého typu obecně brání elektrofilním substitučním reakcím. Ale v meta pozicích vzhledem k druhému typu substituentu je hustota oblaku mírně vyšší než v ostatních. Proto elektrofilní substituční reakce v případě substituentů druhého druhu jdou do meta pozic:
Výše popsaná pravidla nejsou zákony. Téměř vždy se bavíme pouze o hlavním směru reakce. Například nitrace toluenu produkuje 62 % ortho-, 33,5 % para- a 4,5 % meta-nitrotoluenů. Poměrně silný vliv na směr reakcí mají reakční podmínky (teplota, přítomnost katalyzátorů atd.). V přítomnosti dvou orientantů v benzenovém kruhu je možná koordinovaná a nekonzistentní orientace těchto dvou substituentů. V případě nekonzistentní orientace substituentů stejného druhu je směr reakce určen silnějším z nich (viz řady substituentů prvního a druhého druhu):
V případě nekonzistentní orientace substituentů různých typů je směr reakce určen substituentem prvního druhu, protože aktivuje benzenový kruh k elektrofilnímu ataku, např.
60. Podle pravidel substituce zapište nitraci následujících disubstituovaných benzenů: a) m-nitrotoluen; b) p-nitrotoluen; c) o-hydroxytoluen; d) p-chlortoluen; e) kyselina m-nitrobenzoová; f) p-hydroxychlorbenzen; g) m-chlortoluen; h) p-methoxytoluen. 2. Sulfonační reakce nastává, když se areny zahřívají koncentrovanou kyselinou sírovou nebo oleem. Útočným činidlem je molekula SO 3, která hraje roli elektrofilu:
První stupeň sulfonace je pomalý, reakce je obecně reverzibilní:
Sulfonové kyseliny jsou svou silou srovnatelné s minerálními kyselinami, proto jsou ve vodných roztocích v ionizovaném stavu (III). 61. Uveďte rovnice a mechanismy pro sulfonační reakce následujících látek podle pravidel substituce: a) toluen; b) o-xylen; c) nitrobenzen; d) o-nitrotoluen; e) p-chlornitrobenzen; f) m-nitrotoluen; g) p-aminotoluen; h) o methoxytoluen. 3. Halogenační reakce areny za studena za přítomnosti katalyzátorů jako AlCl 3, AlBr 3, FeCl 3 - typická elektrofilní reakce, protože katalyzátory přispívají k polarizaci vazby v molekule halogenu (až k jejímu přetržení): Bezvodý chlorid železitý funguje stejným způsobem:
Za podmínek radikálové reakce (světlo, teplo) nahrazují halogeny (chlor, brom) vodíky postranních řetězců (podobně jako halogenace alkanů):
Za těžších podmínek dochází k radikální adici halogenů na aromatický kruh. 62 . Napište rovnice a reakční mechanismy a pojmenujte produkty: a) toluen + chlór (v jasném světle a zahřívání); b) toluen + chlor (za studena za přítomnosti katalyzátoru); c) nitrobenzen + chlor (za studena za přítomnosti katalyzátoru); d) p-nitrotoluen + chlor (v jasném světle a zahřívání); e) p-nitrotoluen + chlor (za studena za přítomnosti katalyzátoru): e) ethylbenzen + chlór (za jasného světla a zahřívání); g) ethylbenzen + chlor (za studena za přítomnosti katalyzátoru); h) p-hydroxytoluen + chlor (za studena za přítomnosti katalyzátoru); i) m-nitrotoluen + chlor (za studena v přítomnosti katalyzátoru); 4. Alkylace arenů. V přítomnosti bezvodého AlCl 3 (AlBr3) halogenalkany alkylují benzen, ještě snadněji než jeho homology, stejně jako jejich halogenderiváty (Gustavson-Friedel-Craftsovy reakce). Katalyzátor, tvořící komplex A1Cl3, polarizuje vazbu C-Gal, dokud se nerozbije, a proto atakující elektrofilní činidlo:
Alkylace alkeny v přítomnosti A1Cl3, BF3 nebo H3PO4 vede k podobným výsledkům (mechanismus je rovněž elektrofilní):
Alkylace halogenalkany a alkeny jako elektrofilní reakce probíhá v souladu s pravidly pro substituci vodíků na benzenovém kruhu. Proces je však komplikován další alkylací reakčních produktů a dalšími nežádoucími jevy. Pro minimalizaci posledně jmenovaného se reakce provádí při nejnižší možné teplotě, optimálním množství katalyzátoru a velkém přebytku arenu. 63. Uveďte rovnice a reakční mechanismus za podmínek Gustavson-Friedel-Crafts mezi následujícími látkami: a) benzen + 2-chlorpropan; b) benzen + 2-chlor-2-megylpropan; c) benzen + benzylchlorid; d) brombenzen + bromethan; e) toluen + butylchlorid; e) toluen + bromethan; i) p-bromtoluen + isopropyl bromid; h) m-bromtoluen + bromethan; i) p-bromtoluen + isopropyl bromid; j) chlorbenzen + benzylchlorid. 64. Napište reakční rovnice pro alkylaci arenů s alkeny v přítomnosti kyseliny fosforečné, uveďte mechanismus: a) benzen + ethylen; b) benzen + propylen; c) toluen + ethylen; d) toluen + propylen; e) benzen + isobutylen; f) toluen + isobutylen; g) m-xylen + ethylen; h) p-xylen + ethylen. 5. Oxidační reakce (určení počtu postranních řetězců). Aromatické jádro je velmi odolné vůči oxidačním činidlům. Benzen a jeho homology tedy nereagují s manganistanem draselným jako alkany. To také vyjadřuje jejich „aromatický charakter“. Ale když se homology benzenu zahřívají s oxidačními činidly za drsných podmínek, benzenový kruh není oxidován a všechny postranní uhlovodíkové řetězce, bez ohledu na jejich délku, jsou oxidovány na karboxylové skupiny, oxidační produkty jsou aromatické kyseliny. Počet postranních řetězců v původním homologu benzenu 1 je určen počtem karboxylových skupin v tomto homologu.
65 . Napište rovnice pro oxidační reakce následujících látek: a) ethylbenzen; b) o-dimethylbenzen; c) propylbenzen; d) běžný trimethylbenzen; e) p-methylisopropylbenzen; f) o-nitrotoluen; g) 3-nitro-l-methyl-4-ethylbenzen; h) symetrický trimethylbenzen. 6. Adiční reakce. Ačkoli je aromatický kruh méně náchylný k adičním reakcím než substitučním reakcím, za určitých podmínek k nim dochází. Charakteristickým rysem adičních reakcí je, že k jednomu molu benzenu (nebo jeho homologu) se vždy přidají tři moly halogenu, vodíku, ozonu, což se vysvětluje přítomností jediného π-elektronového mraku v aromatickém jádru s určitým jediným , celková energie tří dvojných vazeb (nebo spíše šesti π elektronů). a) Hydrogenace probíhá v přítomnosti katalyzátorů (Pt, Pd atd.) při 110°C (N.D. Zelinsky a další).
b) K halogenaci dochází, když páry bromu nebo chlóru procházejí vroucím benzenem pod vlivem přímého slunečního záření nebo při osvětlení UV paprsky (křemenná lampa):
PROTI) Ozonizace. Podobně jako alkeny i aromatické uhlovodíky snadno podléhají ozonolýze.
66. Napište rovnice pro adiční reakce (hydrogenace, halogenace pod UV zářením, ozonace) s následujícími arény: a) toluen; b) o-xylen; c) m-xylen; d) p-xylen; e) ethylbenzen; f) o-ethyltoluen; g) m-ethyltoluen; h) p-isopropyltoluen. Pojmenujte získané produkty.
O většině se mluvilo
 |