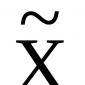Солеобразующие оксиды:
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):оксид лития Li 2 O; оксид натрия Na 2 O; оксид калия K 2 O; оксид меди CuO; оксид серебра Ag2O; оксид магния MgO; оксид кальция CaO; оксид стронция SrO; оксид цезия Cs 2 O; оксид ртути (2) HgO; оксид рубидия Rb 2 O; оксид железа (2) FeO; оксид хрома CrO; оксид никеля NiO.
2). Кислотные оксиды – это оксиды, которым соответствуют кислоты.
К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII:
оксид углерода(IV) CO 2 ; оксид серы(IV) SO 2 ; оксид серы(VI) SO 3 ; оксид кремния(IV) SiO 2 ; оксид фосфора(V) P 2 O 5 ; ксид хрома(VI) CrO 3 ; ксид марганца(VII) Mn 2 O 7 ; оксид азота NO 2 ; ксиды хлора Cl 2 O 5 и Cl 2 O 3 .
3). Амфотерные оксиды – это оксиды , которым соответствуют основания и кислоты. Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют степень окисления от +3 до +4, за исключением ZnO, BeO, SnO, PbO: оксид цинка ZnO; оксид хрома(III) Cr 2 O 3 ; оксид алюминия Al 2 O 3 ; оксид олова(II) SnO; оксид олова(IV) SnO 2 ; оксид свинца(II) PbO; оксид свинца(IV) PbO 2 ; оксид титана(IV) TiO 2 ; оксид марганца(IV) MnO 2 ; оксид железа(III) Fe 2 O 3 ; оксид бериллия BeO.
Несолеобразующие оксиды
1). Несолеобразующие оксиды
– это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II:
оксид углерода(II) CO; оксид азота(II) NO; оксид азота(I) N 2 O; оксид кремния(II) SiO, оксид серы(I) S 2 O; оксид водорода H 2 O.
Основания. Классификация оснований
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион. Общая формула оснований - Э(OН)m, где m – степень окисления металла.
Классификация оснований по силе:
1). Сильные основания.
Растворимые в воде основания называются щелочами:
NaOH - гидроксид натрия (едкий натр); KOH - гидроксид калия (едкое кали); LiOH - гидроксид лития; Ba(OH) 2 - гидроксид бария; Ca(OH) 2 - гидроксид кальция (гашеная известь).
2). Слабые основания:
Mg(OH) 2 - гидроксид магния; Fe(OH) 2 - гидроксид железа (II); Zn(OH) 2 - гидроксид цинка; NH 4 OH - гидроксид аммония; А1 (ОН) 3 - гидроксид алюминия; Fe(OH) 3 - гидроксид железа (III) и т.д. (большинство гидроксидов металлов).
Классификация оснований по растворимости
Более приемлемой является классификация оснований по растворимости их в воде.
1) Растворимые основания. Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, CaOH) 2 , Sr(OH) 2 , Ba(OH) 2 .
2). Нерастворимые основания - это так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
Классификация оснований по числу гидроксильных групп (ОН):
1). Однокислотные основания (n = 1) - это основание, в состав которых входит одна группа - (ОН): LiOH, KOH, NaOH, NH4OH.
2). Двухкислотные основания - (n = 2) - это основание, в состав которых входит две группы - (ОН): Ba(OH) 2 , Mg(OH) 2 , Zn(OH) 2 , Fe(OH) 2 .
3). Трехкислотные основания - (n = 3) - это основание, в состав которых входит три группы - (ОН): Fe(OH) 3 , А1(ОН) 3 и др.
Кислоты. Классификация кислот
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода.
а) Классификация кислот по наличию или отсутствию кислорода в молекуле:
1). Кислородсодержащие кислоты: H 2 SO 4 - серная кислота; H 2 SO 3 - сернистая кислота; HNO 3 - азотная кислота; H 3 PO 4 - фосфорная кислота; H 2 CO 3 - угольная кислота; Н 2 SiO 3 - кремниевая кислота; HClO 4 - хлорная кислота; HClO 3 - триоксохлорат(V) водорода (хлорноватая кислота); HClO 2 - диоксохлорат(III) водорода (хлористая кислота); HClO - оксохлорат(I) водорода (хлорноватистая кислота); H 2 Cr 2 O 7 - гептаоксодихромат(VI) диводорода (дихромовая кислота); H 2 S 4 O 6 - гексаоксотетрасульфат диводорода (тетратионовая кислота); Н 2 В 4 О 6 - гексаоксотетраборат диводорода (тетраметаборная кислота); H - гексагидроксостибат(V) водорода; H 3 PO 3 S - тиофосфорная кислота; HбSO 3 S - тиосерная кислота; H 3 PO 3 - фосфористая (фосфоновая) кислота.
2). Бескислородные кислоты: HF - фтороводородная кислота; HCl - хлороводородная кислота (соляная кислота); HBr - бромоводородная кислота; HI - иодоводородная кислота; H 2 S - сероводородная кислота; HAuCl4 - тетрахлороаурат(III) водорода (золотохлористоводородная кислота); HSCN - роданистоводородная кислота; HN3 - азидоводородная кислота.
б) Классификация кислот по числу атомов водорода:
1). Одноосновные кислоты - это кислоты, в состав которых входит один ион (Н +): HNO 3 - азотная кислота; HF - фтороводородная кислота; HCl - хлороводородная кислота; HBr - бромоводородная кислота; HI - иодоводородная кислота; HClO 4 - хлорная кислота; HClO 3 - триоксохлорат(V) водорода (хлорноватая кислота); HClO 2 - диоксохлорат(III) водорода (хлористая кислота); HClO - оксохлорат(I) водорода (хлорноватистая кислота); HAuCl 4 - тетрахлороаурат(III) водорода (золотохлористоводородная кислота); H - гексагидроксостибат(V) водорода; HSCN - роданистоводородная кислота.
2). Двухосновные кислоты - это кислоты, в состав которых входит два иона (Н +): H 2 SO 4 - серная кислота; H 2 SO 3 - сернистая кислота; H 2 S - сероводородная кислота; H 2 CO 3 - угольная кислота; H 2 SiO 3 - кремниевая кислота; H 2 Cr 2 O 7 - гептаоксодихромат(VI) диводорода (дихромовая кислота); H 2 S 4 O 6 - гексаоксотетрасульфат диводорода (тетратионовая кислота); Н 2 В 4 О 6 - гексаоксотетраборат диводорода (тетраметаборная кислота); H 2 SO 3 S - тиосерная кислота.
3). Трехосновные кислоты - это кислоты, в состав которых входит три иона (Н +): H 3 PO 4 - фосфорная кислота; H3BO3 - борная кислота; H 3 AsO 4 - мышьяковая кислота; H 3 PO 3 S - тиофосфорная кислота; H 3 AlO 3 - ортоалюминиевая кислота; H 3 PO 3 - фосфористая (фосфоновая) кислота.
4). Многоосновные (полиосновные) кислоты - это кислоты, в состав которых входит четыре и более ионов (Н +): H 4 SiO 4 - ортокремниевая кислота; H 4 CO 4 - ортоугольная кислота; H 4 P 2 O 7 - дифосфорная (пирофосфорная) кислота; Н 6 P 6 O 18 - гексафосфорная кислота; H 6 TeO 6 - теллуровая кислота.
Другие классификации кислот:
По силе кислот:
Сильные кислоты - диссоциируют практически полностью, константы диссоциации больше 1 .
10 -3 (HNO 3); HCl; H 2 SO 4);
Слабые кислоты - константа диссоциации меньше 1 .
10 -3 (уксусная кислота Kд = 1,7 .
10 -5).
По устойчивости:
Устойчивые кислоты (H 2 SO 4);
Неустойчивые кислоты (H 2 CO 3).
По принадлежности к классам химических соединений:
Неорганические кислоты: (HBr); (H 2 SO 4);
Органические кислоты: (HCOOH,CH3COOH).
По летучести:
Летучие кислоты: (HNO 3 ,H 2 S);
Нелетучие кислоты: (H 2 SO 4).
По растворимости в воде:
Растворимые кислоты (H 2 SO 4);
Нерастворимые кислоты (H 2 SiO 3).
Соли.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+, например, (NH4)2SO4 – сульфат аммония.
Классификация солей:
1). Средние соли.
Средние соли
- это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков, т.е. они являются продуктами замещения всех катионов водорода в молекулах кислоты на катионы металла (Na 2 CO 3 , K 3 PO 4).
2). Кислые соли.
Кислые соли
- это продукты частичного замещения катионов водорода в кислотах на катионы металла (NaHCO 3 , KH 2 PO 4 , K 2 HPO 4). Они образуются при нейтрализации основания избытком кислоты (то есть в условиях недостатка основания или избытка кислоты).
3). Основные соли.
Основные соли
- это продукты неполного замещения гидроксогрупп основания (OH -) кислотными остатками (CuOH) 2 CO 3 , CoNO 3 (OH). Они образуются в условиях избытка основания или недостатка кислоты.
4). Комплексные соли.
Комплексные соли
- соли, имеющие сложные катионы или анионы, в которых связь образована по донорно-акцепторному механизму. Комплексные ионы, соединяясь с другими ионами, образуют комплексные соли, например, K 4 , Cl, K 2 , (Na 2 ) и др.
Классификация солей по числу присутствующих в структуре катионов и анионов
Вывыделяют следующие типы солей:
1). Простые соли.
Простые соли
- это соли, состоящие из одного вида катионов и одного вида анионов (NaCl).
2). Двойные соли.
Двойные соли
- это соли, содержащие два различных типа катионов. примером двойных солей являются (KAl(SO 4) 2 .
12H 2 O) (алюмокалиевые квасцы), KAl(SO4) 2 (сульфат алюминия-калия), MgK 2 (SO4) 2 , AgK(CN) 2 . Двойные соли существуют только в твердом виде.
3). Смешанные соли.
Смешанные соли
- это соли, в составе которых присутствует два различных аниона (Ca(OCl)Cl), Fe(NH 4) 2 (SO 4) 2 [сульфат диаммония-железа(II)], LiAl(SiO 3) 2 (метасиликат алюминия-лития), Ca(ClO)Cl (хлорид-гипохлорит кальция), Na 3 CO 3 (HCO 3) (гидрокарбонат-карбонат натрия), Na 2 IO 3 (NO 3) (нитрат-иодат натрия)
4). Гидратные соли (кристаллогидраты).
Гидратные соли или кристаллогидраты
- это соли, в состав которых входят молекулы кристаллизационной воды, например, Na 2 SO 4 ·10 H 2 O, CaSO 4 ·
2H 2 O (гиппс), MgCl 2 ·
KCl·
6H 2 O (карналлит), CuSO 4 ·
5H 2 O (медный купорос), FeSO 4 ·
7H 2 O (железный купорос), Na 2 CO 3 ·
10H 2 O (кристаллическая сода).
5). Внутренние соли.
Внутренние соли
- это соли, которые образованы биполярными ионами, то есть молекулами, содержащими как положительно заряженный, так и отрицательно заряженный атом (+) NН 3 -CH 2 -COO (-) (биполярный ион аминокислоты глицина), (+) NH 3 -C 6 H 4 -SO 3 (-) (сульфаниловая кислота или таурин). Таурин
- сульфокислота, образующаяся в организме из аминокислоты цистеина.
В настоящее время известно более 118 химических элементов: по различным источникам, в природе встречаются от 88 до 94. Химические элементы образуют огромное количество неорганических соединений. Хотя каждому соединению присущи свои особенности, свои специфические свойства, имеется целый ряд веществ с некоторыми сходными, общими свойствами. Исходя из общности свойств, соединения объединяют в группы, классы, то есть классифицируют их, что облегчает изучение многообразия веществ.
Вспомним, что, исходя их состава молекул, вещества делятся на простые и сложные.
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Простые вещества разбиваются на две большие группы: металлы и неметаллы.
Металлы – группа элементов, обладающая характернымиметаллическими свойствами: твёрдые вещества (исключение составляет ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие.
 А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
Оксиды – это сложные вещества, в состав молекул которых входят атомы кислорода и какого – нибудь другого вещества.
Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
С точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH 4 +) и гидроксид – анионы OH - .
Кислоты – это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла.
Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом.
Остались вопросы? Хотите знать больше о классификации неорганических соединений?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
В химии все многообразие неорганических веществ: принято разделять на две группы – простые и сложные. Простые вещества подразделяются на металлы и неметаллы. А сложные – на производные от простых, образованные путем их взаимодействия с кислородом, водой и между собой. Эту классификацию неорганических веществ в виде схемы изображают следующим образом:
Рис. 2.1. Классификация неорганических соединений.
Классификация реакций в неорганической химии. В неорганической химии различают реакции: 1)соединения, 2)разложения (и те и другие могут быть окислительно-восстановительными реакциями, а могут и не быть таковыми), 3)обмена, 4)замещения, которые всегда являются окислительно-восстановительными. Схемы реакций и примеры даны в таблице 2.1.
Таблица 2.1
Классификация реакций
Рассмотрим получение и свойства наиболее важных классов неорганических соединений.
ОКСИДЫ (окислы) - сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления, равной -2. Общая формула любого оксида - Э х О у -2 . Различают солеобразующие (основные : Li 2 O, CaO, MgO ,FeO; амфотерные : ZnO, Al 2 O 3 , SnO 2 , Cr 2 O 3 , Fe 2 O 3 ; кислотные : B 2 O 3 , SO 3 , CO 2 , P 2 O 5 Mn 2 O 7) и несолеобразующие : N 2 O, NO, CO оксиды. Элементы с переменной степенью окисления образуют несколько оксидов (MnO, MnO 2 , Mn 2 O 7 , NO, N 2 O 3 , NO 2 , N 2 O 5). В высшем оксиде, как правило, элемент находится в степени окисления, равной номеру группы.
По современной международной номенклатуре названия оксидов составляют следующим образом: слово «оксид», далее русское название элемента в родительном падеже, степень окисления элемента (если она переменна). Например: FeO – оксид железа (II), P 2 O 5 – оксид фосфора (V).
Основные оксиды это те, которым соответствуют гидроксиды – основания. Основными называют оксиды, взаимодействующие с кислотами с образованием соли и воды. Основные оксиды образуются только металлами в степени окисления +1,+2 (иногда +3), например: BaO, SrO, FeO, MnO, CrO, Li 2 O, Bi 2 O 3 , Ag 2 O.
Получение основных оксидов :
1) Окисление металлов при нагревании в атмосфере кислорода:
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na 2 O, K 2 O крайне труднодоступны.
2) Обжиг сульфидов:
2СuS+3O 2 =2CuO+2SO 2 ;
4FeS 2 +11O 2 =2Fe 2 O 3 +8SO 2 .
3) Разложение гидроксидов:
Cu(OH) 2 =CuO+H 2 O.
Этим методом нельзя получить оксиды щелочных металлов.
4) Разложение солей некоторых кислородсодержащих кислот:
BaCO 3 =BaO+CO 2 ,
2Pb(NO 3) 2 =2PbO+4NO 2 +O 2
Свойства основных оксидов . Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера; в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с ионами O 2- , поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава, и могут существовать смешанные оксиды переменного состава.
1) Отношение к воде.
Процесс присоединения воды называется гидратацией, а образующееся вещество – гидроксидом. Из основных оксидов с водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных металлов (Ca, Sr, Ba, Ra).
Li 2 O+H 2 O=2LiOH;
BaO+H 2 O=Ba(OH) 2 .
Большинство же основных оксидов в воде не растворяются и не взаимодействуют с ней. Соответствующие их гидроксиды получают косвенным путем – действием щелочей на соли (см. ниже).
2) Отношение к кислотам.
CaO+H 2 SO 4 =CaSO 4 +H 2 O;
FeO+2HCl=FeCl 2 +H 2 O.
3) Отношение к кислотным и амфотерным оксидам.
Основные оксиды щелочных и щелочноземельных металлов при сплавлении взаимодействуют с твердыми кислотными и амфотерными оксидами, а также с газообразными кислотными оксидами при обычных условиях.
CaO+CO 2 =CaCO 3;
3BaO+P 2 O 5 =Ba 3 (PO 4) 2 ;
сплавление
Li 2 O+Al 2 O 3 =2LiAlO 2 .
сплавление
Основные оксиды менее активных металлов взаимодействуют только с твердыми кислотными оксидами при сплавлении.
Кислотные оксиды - оксиды, которые при взаимодействии с основаниями образуют соль и воду. Кислотным оксидам соответствуют гидроксиды – кислоты. Кислотные оксиды – это оксиды неметаллов в различных степенях окисления, либо оксиды металлов в высокой степени окисления (+4 и выше). Примеры: SO 2 , SO 3 , Cl 2 O 7 , Mn 2 O 7 , CrO 3 .
Химическая связь в кислотных оксидах – ковалентная полярная. При обычных условиях кислотные оксиды неметаллов могут быть газообразными (CO 2 , SO 2), жидкими (N 2 O 3 , Cl 2 O 7), твердыми (P 2 O 5 , SiO 2).
Получение кислотных оксидов .
1) Окисление неметаллов:
2) Окисление сульфидов:
2ZnS+3O 2 =2ZnO+2SO 2
3) Вытеснение непрочных слабых кислот из их солей:
CaCO 3 +2HCl=CaCl 2 +CO 2 +H 2 O.
Свойства кислотных оксидов .
1) Отношение к воде.
Большинство кислотных оксидов растворяются в воде, вступая с ней в химическое взаимодействие и образуя кислоты:
SO 3 +H 2 O=H 2 SO 4 ,
CO 2 +H 2 O=H 2 CO 3 .
2) Отношение к основаниям.
Кислотные оксиды взаимодействуют с растворимыми основаниями – щелочами, образуя соль и воду.
SO 2 +2NaOH=Na 2 SO 3 +H 2 O;
P 2 O 5 +6NaOH=2Na 3 PO 4 +3H 2 O
сплавление
3) Отношение к основным и амфотерным оксидам.
Твердые кислотные оксиды взаимодействуют с основными и амфотерными оксидами при сплавлении. Жидкие и газообразные оксиды взаимодействуют с оксидами щелочных и щелочноземельных металлов при обычных условиях.
P 2 O 5 +3CuO=Cu 3 (PO 4) 2 ;
сплавление
3SiO 2 +Al 2 O 3 =Al 2 (SiO 3) 3
сплавление
Амфотерные оксиды взаимодействуют и с кислотами и со щелочами, проявляя свойства кислотных и основных оксидов. Им соответствуют амфотерные гидроксиды. Все они твердые вещества, нерастворимые в воде. Примеры амфотерных оксидов: ZnO, BeO, SnO, PbO, Al 2 O 3 , Cr 2 O 3 , Sb 2 O 3 , MnO 2 .
Свойства амфотерных оксидов .
Амфотерные оксиды реагируют с кислотами как основные:
Al 2 O 3 +6HCl=2AlCl 3 +3H 2 O,
а со щелочами – как кислотные. Состав продуктов реакции зависит от условий. При сплавлении:
ZnO+2NaOH=Na 2 ZnO 2 +H 2 O;
Цинкат натрия
В растворе щелочи образуется растворимая комплексная соль, содержащая гидроксокомплексный ион:
ZnO+2NaOH+H 2 O=Na 2
Тетрагидроксоцинкат натрия
Несолеобразующие оксиды – это оксиды неметаллов, которым не соответствуют гидроксиды и соли. Примеры: CO, N 2 O, NO, SiO.
Оксиды широко распространены в природе. Так вода – самый распространенный оксид покрывает 71% поверхности планеты. Оксид кремния (IV) в виде 400 разновидностей кварца составляет 12% от массы земной коры. Оксид углерода (IV) (углекислый газ) содержится в атмосфере - 0,03% по объему, а также в природных водах. Важнейшие руды: гематит, магнетит, бурый железняк состоят из различных оксидов железа. Бокситы содержат оксид алюминия, и т.д.
ОСНОВАНИЯ – сложные вещества, в которых на атом металла приходится одна или несколько гидроксогрупп ОН - . Степень окисления атомов металла обычно +1, +2 (реже +3). Общая формула оснований Ме(ОН) х, где х – число гидроксогрупп – кислотность основания. (МеОН – однокислотное, Ме(ОН) 2 – двухкислотное, Ме(ОН) 3 – трехкислотное основание).
Названия основаниям дают следующим образом: «гидроксид», затем русское название металла в родительном падеже, а в скобках римскими цифрами – степень окисления, если она переменная. Например: KOH –гидроксид калия, Ni(OH) 2 – гидроксид никеля(II).
При обычных условиях основания – твердые вещества, кроме гидроксида аммония – водного раствора аммиака NH 4 OH (NH 4 + - ион аммония, входящий в состав солей аммония).
Классификация оснований. В зависимости от отношения к воде основания делятся на растворимые (щелочи) и нерастворимые. К растворимым основаниям - щелочам относятся только гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, CsOH, RbOH, FrOH, Ca(OH) 2 , Sr(OH) 2 , Ba(OH) 2 , Ra(OH) 2) а также водный раствор аммиака. Все остальные основания практически нерастворимы в воде.
С точки зрения теории электролитической диссоциации основания – электролиты, диссоциирующие в водном растворе с образованием в качестве анионов только гидроксид-ионов:
Ме(ОН) х Ме х+ + хОН - .
Наличие в растворе ионов гидроксида определяют с помощью индикаторов: лакмуса (синий), фенолфталеина (малиновый), метилоранжа (желтый). Нерастворимые основания не меняют окраски индикаторов.
Классификация веществ
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, сложные – из двух и более элементов. Простые вещества разделяются на металлы и неметаллы.
Металлы имеют характерный «металлический» блеск, обладают ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
Сложные вещества делят на органические и неорганические (минеральные). Органическими принято называть соединения углерода, за исключением простейших соединений углерода (CO, CO 2 , H 2 CO 3 , HCN и их солей и др.); все остальные вещества называются неорганическими.
Сложные неорганические соединения классифицируются как по составу, так и по химическим свойствам (функциональным признакам). По составу они, прежде всего, подразделяются на двухэлементные, или бинарные, соединения (оксиды, сульфиды, галогениды, нитриды, карбиды, гидриды) и многоэлементные соединения; кислородсодержащие, азотсодержащие и т. п.
По химическим свойствам неорганические соединения подразделяются на четыре основных класса: оксиды, кислоты, основания, соли.
Оксиды
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород (Cr 2 O 3 , K 2 O, CO 2 и т. д.). Кислород в оксидах всегда двухвалентен и имеет степень окисления, равную -2.
По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие (безразличные: CO, NO, N 2 O). Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
Основными называются оксиды, взаимодействующие с кислотами или кислотными оксидами, с образованием солей:
CuO + 2HCl=CuCl 2 + H 2 O,
MgO + CO 2 = MgCO 3 .
Образование основных оксидов характерно для металлов с невысокой степенью окисления (+1, +2).
Оксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных металлов (Ca, Sr, Ba, Ra) взаимодействуют с водой, образуя основания. Например:
Na 2 O + H 2 O = 2NaOH,
CaO + H 2 O = Ca(OH) 2 .
Большая часть основных оксидов с водой не взаимодействует. Основания таких оксидов получают косвенным путем:
a) CuO + 2HCl=CuCl 2 + H 2 O;
б) CuCl 2 + 2KOH = Cu(OH) 2 +2KCl.
Кислотными называются оксиды, взаимодействующие с основаниями или с основными оксидами с образованием солей. Например:
SO 3 + 2KOH = K 2 SO 4 + H 2 O,
CaO + CO 2 = CaCO 3 .
К кислотным оксидам относятся оксиды типичных неметаллов -SO 2 , N 2 O 5 , SiO 2 , CO 2 и др., а также оксиды металлов с высокой степенью окисления (+5,+6,+7, +8) -V 2 O 5 , CrO 3 , Mn 2 O 7 и др.
Ряд кислотных оксидов (SO 3 , SO 2 , N 2 O 3 , N 2 O 5 , CO 2 и др.) при взаимодействии с водой образуют кислоты:
SO 3 + H 2 O = H 2 SO 4 ,
N 2 O 5 + H 2 O = 2HNO 3 .
Соответствующие кислоты других кислотных оксидов (SiO 2 , TeO 2 , TeO 3 , MoO 3 , WO 3 , и др.) получают косвенным путем. Например:
а) SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O
б) Na 2 SiO 3 +2HCl= H 2 SiO 3 + 2NaCl
Один из способов получения кислотных оксидов – отнятие воды от соответствующих кислот. Поэтому кислотные оксиды иногда называют ангидридами кислот.
Амфотерными называют оксиды, образующие соли при взаимодействии, как с кислотами, так и с основаниями, т. е. обладающие двойственными свойствами – свойствами основных и кислотных оксидов. Например:
SnO + H 2 SO 4 = SnSO 4 + H 2 O,
SnO + 2KOH + H 2 O = K 2 ,
ZnO + 2KOH = K 2 ZnO 2 + H 2 O.
К числу амфотерных оксидов относятся: ZnO, BeO, SnO, PbO, Al 2 O 3 , Cr 2 O 3 , Fe 2 O 3 , Sb 2 O 3 , MnO 2 и др.
Следует отметить, что в соответствии с изменением химической природы элементов в периодической системе элементов (от металлов к неметаллам) закономерно изменяются и химические свойства соединений, в частности, кислотно-основная активность их оксидов. Так, в случае высших оксидов элементов 3 периода в ряду: Na 2 O, MgO, Al 2 O 3 , SiO 2 , P 2 O 5 , SO 3 , Cl 2 O 7 - по мере уменьшения степени полярности связи Э-О (уменьшается DЭО; уменьшается отрицательный эффективный заряд атома кислорода) ослабляются основные и нарастают кислотные свойства оксидов: Na 2 O, MgO - основные оксиды; Al 2 O 3 – амфотерный; SiO 2 , P 2 O 5 , SO 3 , Cl 2 O 7 - кислотные оксиды (слева направо кислотный характер оксидов усиливается).
Способы получения оксидов:
1. Взаимодействие простых веществ с кислородом (окисление):
4Fe + 3O 2 = 2Fe 2 O 3 ,
S + O 2 = SO 2 .
2. Горение сложных веществ:
CH 4 + 2O 2 = CO 2 + 2H 2 O,
2SO 2 + O 2 = 2SO 3 .
3. Термическое разложение солей, оснований, кислот:
CaCO 3 ® CaO + CO 2 ,
Cd(OH) 2 ® CdO + H 2 O,
H 2 SO 4 ® SO 3 + H 2 O.
Номенклатура оксидов. Названия оксидов строятся из слова “оксид” и названия элемента в родительном падеже, который соединен с атомами кислорода. Если элемент образует несколько оксидов, то в скобках римскими цифрами указывается его степень окисления (с.о.), при этом знак с. о. не указывается. Например, MnO 2 – оксид марганца (IV), MnO – оксид марганца (II). Если элемент образует один оксид, то его с. о. не приводится: Na 2 O – оксид натрия.
Иногда в названиях оксидов встречаются приставки ди-, три-, тетра- и т.д. Они обозначают, что в молекуле этого оксида на один атом элемента приходится 2,3,4 и т.д. атома кислорода, например, CO 2 – диоксид углерода и т.д.
Гидроксиды
Среди многоэлементных соединений важную группу составляют гидроксиды – сложные вещества, содержащие гидроксогруппы OH. Некоторые из них (основные гидроксиды) проявляют свойства оснований - NaOH, Ba(OH) 2 и т.п.; другие (кислотные гидроксиды) проявляют свойства кислот – HNO 3 , H 3 PO 4 , и др.; существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как основные, так и кислотные свойства - Zn(OH) 2 , Al(OH) 3 и др.
Свойства и характер гидроксидов также находятся в зависимости от заряда ядра центрального атома (условное обозначение Э) и его радиуса, т.е. от прочности и полярности связей Э – О и О – Н.
Если энергия связи E O - H << E Э - О, то диссоциация гидроксида протекает по кислотному типу, т. е. разрушается связь О – Н.
ЭОН Û ЭО - + H +
Если E O-H >> E Э – O , то диссоциация гидроксида протекает по основному типу, т. е. разрушается связь Э - O
ЭOH Û Э + + OH -
Если энергии связей O – H и Э – О близки или равны, то диссоциация гидроксида может протекать одновременно по обоим направлениям. В этом случае речь идет об амфотерных гидроксидах:
Э n+ + nOH - Û Э(OH) n = H n ЭO n Û nH + + ЭО n n-
В соответствии с изменением химической природы элементов в периодической системе элементов закономерно изменяется кислотно-основная активность их гидроксидов: от основных гидроксидов через амфотерные к кислотным. Например, для высших гидроксидов элементов 3 периода:
NaOH, Mg(OH) 2 – основания (слева направо основные свойства ослабевают);
Al(OH) 3 – амфотерный гидроксид;
H 2 SiO 3 , H 3 PO 4 , H 2 SO 4 , HСlO 4 – кислоты (слева направо сила кислот увеличивается).
Гидроксиды металлов относятся к основаниям. Чем ярче выражены металлические свойства элемента, тем сильнее выражены основные свойства соответствующего гидроксида металла в высшей с.о. Гидроксиды неметаллов проявляют кислотные свойства. Чем ярче выражены неметаллические свойства элемента, тем сильнее кислотные свойства соответствующего гидроксида.
Кислоты
Кислоты – это вещества, диссоциирующие в растворах с образованием катионов водорода и анионов кислотного остатка (с позиций теории электролитической диссоциации).
Кислоты классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по основности (по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли – на одноосновные, двухосновные, трехосновные), по наличию или отсутствию кислорода в составе кислоты (на кислородсодержащие и бескислородные). Например, азотная кислота HNO 3 – сильная, одноосновная, кислородсодержащая кислота; сероводородная кислота H 2 S – слабая, двухосновная, бескислородная кислота.
Химические свойства кислот:
1. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H 2 SO 4 + Cu (OH) 2 = CuSO 4 + 2H 2 O.
2. Взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
2HNO 3 + MgO = Mg(NO 3) 2 + H 2 O,
H 2 SO 4 + ZnO = ZnSO 4 + H 2 O.
3. Взаимодействие с металлами. Металлы, стоящие в “Ряду напряжений” до водорода, вытесняют водород из растворов кислот (кроме азотной и концентрированной серной кислот); при этом образуется соль:
Zn + 2HCl =ZnCl 2 + H 2 .
Металлы, находящиеся в “Ряду напряжений” после водорода, водород из растворов кислот не вытесняют
Взаимодействие металлов с азотной и концентрированной серной кислотами см. в разделе 11.
4. Некоторые кислоты при нагревании разлагаются:
H 2 SiO 3 H 2 O + SiO 2 .
5. Менее летучие кислоты вытесняют более летучие кислоты из их солей:
H 2 SO 4 конц + NaCl тв = NaHSO 4 + HCl.
6. Более сильные кислоты вытесняют менее сильные кислоты из растворов их солей:
2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
Номенклатура кислот. Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например, CN – циан, CNS – родан) суффикс -о- , окончание водородная и слово “кислота”. Например, HCl – хлороводородная кислота, H 2 S – сероводородная кислота, HCN – циановодородная кислота.
Названия кислородосодержащих кислот также образуются от русского названия кислотообразующего элемента с добавлением соответствующих суффиксов, окончаний и слова “кислота”. При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на -ная или -овая ; например, H 2 SO 4 – серная кислота, HClO 4 – хлорная кислота, H 3 AsO 4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: -оватая (HClO 3 - хлорноватая кислота), истая (HClO 2 - хлористая кислота), -оватистая (HClO - хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающее более низкой степени окисления элемента, имеет окончание истая (HNO 3 – азотная кислота, HNO 2 – азотистая кислота).
В некоторых случаях к одной молекуле оксида может присоединиться различное количество молекул воды (т.е. элемент в одной и той же степени окисления образует несколько кислот, содержащих по одному атому данного элемента). Тогда кислоту с большим содержанием воды обозначают приставкой орто - , а кислоту с меньшим числом молекул воды обозначают приставкой мета - . Например:
P 2 O 5 + H 2 O = 2HPO 3 - метафосфорная кислота;
P 2 O 5 + 3H 2 O = 2H 3 PO 4 - ортофосфорная кислота.
Основания
Основаниями с позиций теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид - ионов OH ‾ и ионов металлов (исключение NH 4 OH).
Основания классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по кислотности (по количеству гидроксогрупп в молекуле, способных замещаться на кислотные остатки – на однокислотные, двукислотные и т. д.), по растворимости (на растворимые основания – щелочи и нерастворимые). Например: NaOH – сильное, однокислотное основание, растворимое (щелочь); Cu(OH) 2 – слабое, двукислотное, нерастворимое основание. К растворимым основаниям (щелочам) относятся гидроксиды щелочных и щелочноземельных металлов. К сильным основаниям относятся все щелочи.
Химические свойства оснований:
1. Взаимодействие с кислотами:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 ¯ + H 2 O.
2. Взаимодействие с кислотными оксидами:
3. Взаимодействие с амфотерными оксидами:
2KOH + Al 2 O 3 = 2KAlO 2 + H 2 O 1,
2KOH + SnO + H 2 O = K 2 [ Sn(OH) 4 ].
4. Взаимодействие с амфотерными основаниями:
2NaOH + Zn(OH) 2 = Na 2 ZnO 2 +2H 2 O2,
2NaOH + Zn(OH) 2 = Na 2 [ Zn(OH) 4 ]3.
5. Термическое разложение оснований с образованием оксидов и воды:
Ca(OH) 2 = CaO + H 2 O.
Гидроксиды щелочных металлов при нагревании не распадаются.
6. Взаимодействие с амфотерными металлами (Zn, Al, Pb, Sn, Be):
Zn + 2NaOH + 2H 2 O = Na 2 + H 2
Амфотерные гидроксиды. Амфотерные гидроксиды (гидраты амфотерных оксидов) способны диссоциировать в водных растворах как по типу кислот, так и по типу оснований. Например:
ZnO 2 2- + 2H + Û Zn(OH) 2 Û Zn 2+ + 2OH .
Поэтому они обладают амфотерными свойствами, т.е. могут взаимодействовать как с кислотами, так и с основаниями:
Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O,
Sn(OH) 2 + 2NaOH = Na 2 [ Sn(OH) 4 ].
Номенклатура оснований. Названия оснований строятся из слова “гидроксид ” и названия металла в родительном падеже с указанием в скобках римскими цифрами его степени окисления, если это величина переменная. Иногда к слову гидроксид добавляют префикс из греческого числительного, указывающий на число гидроксогрупп в молекуле основания. Например: KOH - гидроксид калия; Al(OH) 3 - гидроксид алюминия (тригидроксид алюминия); Cr(OH) 2 – гидроксид хрома (II) (дигидроксид хрома).
Соли
С точки зрения теории электролитической диссоциации соли - это вещества, диссоциирующие в растворах или в расплавах с образованием положительно заряженных ионов, отличных от ионов водорода, и отрицательно заряженных ионов, отличных от гидроксид – ионов.
Соли рассматривают обычно как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками. При полном замещении получаются средние (или нормальные) соли, диссоциирующие в растворах или в расплавах с образованием катионов металлов и анионов кислотных остатков (исключение – соли аммония). При неполном замещении водорода кислоты получаются кислые соли, при неполном замещении гидроксогрупп основания – основные соли. Диссоциация кислых и основных солей рассматривается в разделе 8. Кислые соли могут быть образованы только многоосновными кислотами (H 2 SO 4 , H 2 SO 3 , H 2 S,H 3 PO 4 и т. д.), а основные соли – многокислотными основаниями (Mg (OH) 2 ,Ca (OH) 2 , Al (OH) 3 и т. д.).
Примеры образования солей:
Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O,
CaSO 4 (сульфат кальция) – нормальная (средняя) соль;
H 2 SO 4 + NaOH = NaHSO 4 + H 2 O,
NaHSO 4 (гидросульфат натрия) – кислая соль, полученная в результате недостатка взятого основания;
Cu (OH) 2 + HCl = CuOHCl + H 2 O,
CuOHCl (хлорид гидроксомеди (II)) – основная соль, полученная в результате недостатка взятой кислоты.
Химические свойства солей:
I. Соли вступают в реакции ионного обмена, если при этом образуется осадок, слабый электролит или выделяется газ:
с щелочами реагируют соли, катионам металлов которых соответствуют нерастворимые основания:
CuSO 4 + 2NaOH = Na 2 SO 4 + Cu (OH) 2 ↓;
с кислотами взаимодействуют соли:
а) катионы которых образуют с анионом новой кислоты нерастворимую соль:
BaCl 2 + H 2 SO 4 = BaSO 4 ↓ + 2HCl;
б) анионы которой отвечают неустойчивой угольной или какой-либо летучей кислоте (в последнем случае реакция проводится между твердой солью и концентрированной кислотой):
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ,
NaCl тв + H 2 SO 4конц = NaHSO 4 + HCl;
в) анионы которой отвечают малорастворимой кислоте:
Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl;
г) анионы которой отвечают слабой кислоте:
2CH 3 COONa + H 2 SO 4 = Na 2 SO 4 + 2CH 3 COOH;
cоли взаимодействуют между собой, если одна из образующихся новых солей нерастворима или разлагается (полностью гидролизуется) с выделением газа или осадка:
AgNO 3 + NaCl = NaNO 3 + AgCl↓,
2AlCl 3 + 3Na 2 CO 3 + 3H 2 O = 2Al (OH) 3 ↓ + 6NaCl + 3CO 2 .
II. Соли могут вступать во взаимодействие с металлами, если металл, которому соответствует катион соли, находится в“Ряду напряжений “правее реагирующего свободного металла (более активный металл вытесняет менее активный металл из раствора его соли):
Zn + CuSO 4 = ZnSO 4 + Cu.
III. Некоторые соли разлагаются при нагревании:
CaCO 3 = CaO + CO 2 .
IV. Некоторые соли способны реагировать с водой и образовывать кристаллогидраты:
CuSO 4 + 5H 2 O = CuSO 4 ٭ 5H 2 O ΔH<0
белого цвета сине-голубого цвета
Выделение теплоты и изменение цвета – признаки химических реакций.
V. Соли подвергаются гидролизу. Подробно этот процесс будет описан в разделе 8.10.
VI. Химические свойства кислых и основных солей отличаются от свойств средних солей тем, что кислые соли вступают также во все реакции, характерные для кислот, а основные соли вступают во все реакции, характерные для оснований. Например:
NaHSO 4 + NaOH= Na 2 SO 4 + H 2 O,
MgOHCl + HCl = MgCl 2 + H 2 O.
Получение солей:
1. Взаимодействие основного оксида с кислотой:
CuO + H 2 SO 4 = CuSO 4 + H 2 O.
2. Взаимодействие металла с солью другого металла:
Mg + ZnCl 2 = MgCl 2 + Zn.
3. Взаимодействие металла с кислотой:
Mg + 2HCl = MgCl 2 + H 2 .
4. Взаимодействие основания с кислотным оксидом:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
5. Взаимодействие основания с кислотой:
Fe(OH) 3 + 3HCl= FeCl 3 + 3H 2 O.
6. Взаимодействие соли с основанием:
FeCl 2 + 2KOH = Fe(OH) 2 ¯ + 2KCl.
7. Взаимодействие двух солей:
Ba(NO 3) 2 + K 2 SO 4 = BaSO 4 ¯ + 2KNO 3 .
8. Взаимодействие металла с неметаллом:
9. Взаимодействие кислоты с солью:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 .
10. Взаимодействие кислотного и основного оксидов:
CaO + CO 2 = CaCO 3 .
Номенклатура солей. Согласно международным номенклатурным правилам, названия средних солей образуются из названия кислотного остатка в именительном падеже и названия металла в родительном падеже с указанием в скобках римскими цифрами его степени окисления (если это величина переменная). Название кислотного остатка состоит из корня латинского наименования кислотообразующего элемента, соответствующего окончанияи в некоторых случаях приставки.
Кислотные остатки бескислородных кислот получают окончание ид . Например: SnS – сульфид олова (II), Na 2 Se – селенид натрия. Окончания названий кислотных остатков кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента. Для высшей его степени окисления (“-ная “ или “-овая “ кислота) применяется окончание -ат . Например, соли азотной кислоты HNO 3 называются нитратами, серной кислоты H 2 SO 4 - сульфатами, хромовой кислоты H 2 CrO 4 – хроматами. Для более низкой степени окисления кислотообразующего элемента (“...истая кислота “) применяется окончание ит. Так, соли азотистой кислоты HNO 2 называются нитритами, сернистой кислоты H 2 SO 3 – сульфитами. Если существует кислота с еще более низкой степенью окисления кислотообразующего элемента (“-оватистая кислота “), ее анион получает приставку гипо- и окончание -ит . Например, соли хлорноватистой кислоты HClО называют гипохлоритами.
Соли некоторых кислот в соответствии с исторически сложившейся традицией сохранили названия, отличающиеся от систематических. Так, соли марганцовой кислоты HMnO 4 называют перманганатами, хлорной кислоты HClO 4 – перхлоратами, йодной кислоты HIO 4 – периодатами. Соли марганцовистой кислоты H 2 MnO 4 , хлорноватой HClO 3 и йодноватой HIO 3 кислот называют соответственно манганатами, хлоратами и йодатами.
Названия кислых и основных солей образуются по тем же общим правилам, что и названия средних солей. При этом название аниона кислой соли снабжают приставкой гидро-, указывающей на наличие незамещенных атомов водорода; количество незамещенных атомов водорода указывают греческими числительными приставками. Например, Na 2 HPO 4 – гидроортофосфат натрия, NaH 2 PO 4 – дигидроортофосфат натрия.
Аналогично катион основной соли получает приставку гидроксо- , указывающую на наличие незамещенных гидроксогрупп. Число гидроксильных групп указывают греческим числительным. Например, Cr(OH) 2 NO 3 – нитрат дигидроксохрома (III).
Названия важнейших кислот и их кислотных остатков приведены табл. 4.1.
Таблица 4.1
Названия и формулы кислот и их кислотных остатков
Продолжение табл. 4.1
Классификация неорганических веществ и их номенклатура основаны на наиболее простой и постоянной во времени характеристике -
химическом составе , который показывает атомы элементов, образующих данное вещество, в их числовом отношении. Если вещество из атомов одного химического элемента, т.е. является формой существования этого элемента в свободном виде, то его называют простым веществом ; если же вещество из атомов двух или большего числа элементов, то его называют сложным веществом . Все простые вещества (кроме одноатомных) и все сложные вещества принято называть химическими соединениями , так как в них атомы одного или разных элементов соединены между собой химическими связями.Номенклатура неорганических веществ состоит из формул и названий. Химическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков. Химическое название - изображение состава вещества с помощью слова или группы слов. Построение химических формул и названий определяется системой номенклатурных правил .
Символы и наименования химических элементов приведены в Периодической системе элементов Д.И. Менделеева. Элементы условно делят на металлы
и неметаллы . К неметаллам относят все элементы VIIIА-группы (благородные газы) и VIIА-группы (галогены), элементы VIА-группы (кроме полония), элементы азот, фосфор, мышьяк (VА-группа); углерод, кремний (IVА-группа); бор (IIIА-группа), а также водород. Остальные элементы относят к металлам.При составлении названий веществ обычно применяют русские наименования элементов, например, дикислород, дифторид ксенона, селенат калия. По традиции для некоторых элементов в производные термины вводят корни их латинских наименований:
|
Ag - аргент |
N - нитр |
|
As - арс, арсен |
Ni - никкол |
|
Au - аур |
O - окс, оксиген |
|
C - карб, карбон |
Pb - плюмб |
|
Cu - купр |
S - сульф |
|
Fe - ферр |
Sb - стиб |
|
H - гидр, гидроген |
Si - сил, силик, силиц |
|
Hg - меркур |
Sn - станн |
|
Mn - манган |
Например
: карбонат, манганат, оксид, сульфид, силикат.Названия простых веществ состоят из одного слова - наименования химического элемента с числовой приставкой, например:
Используются следующие числовые приставки
:|
1 - моно |
7 - гепта |
|
2 - ди |
|
|
3 - три |
9 - нона |
|
4 - тетра |
|
|
5 - пента |
11 - ундека |
|
6 - гекса |
12 - додека |
Неопределенное число указывается числовой приставкой
n - поли.Для некоторых простых веществ используют также специальные названия, такие, как О
3 - озон, Р 4 - белый фосфор.Химические формулы сложных веществ составляют из обозначения электроположительной (условных и реальных катионов) и электроотрицательной (условных и реальных анионов) составляющих, например,
CuSO 4 (здесь Cu 2+ - реальный катион, SO 4 2- - реальный анион) и PCl 3 (здесь P +III - условный катион, Cl - I - условный анион).Названия сложных веществ составляют по химическим формулам справа налево. Они складываются из двух слов - названий электроотрицательных составляющих (в именительном падеже) и электроположительных составляющих (в родительном падеже), например:
CuSO 4 -
сульфат меди(II) Число электроположительных и электроотрицательных составляющих в названиях указывают числовыми приставками, приведенными выше (универсальный способ), либо степенями окисления (если они могут быть определены по формуле) с помощью римских цифр в круглых скобках (знак плюс опускается). В ряде случаев приводят заряд ионов (для сложных по составу катионов и анионов), используя арабские цифры с соответствующим знаком. Для распространенных многоэлементных катионов и анионов применяют следующие специальные названия:
PCl 3 -
трихлорид фосфора
LaCl 3 -
хлорид лантана(III)
СО -
монооксид углерода
|
H 2 F + - фтороний |
C 2 2- - ацетиленид |
|
H 3 O + - оксоний |
CN - - цианид |
|
H 3 S + - сульфоний |
CNO - - фульминат |
|
NH 4 + - аммоний |
HF 2 - - гидродифторид |
|
N 2 H 5 + - гидразиний(1+) |
HO 2 - - гидропероксид |
|
N 2 H 6 + - гидразиний(2+) |
HS - - гидросульфид |
|
NH 3 OH + - гидроксиламиний |
N 3 - - азид |
|
NO + - нитрозил |
NCS - - тиоционат |
|
NO 2 + - нитроил |
O 2 2 - - пероксид |
|
O 2 + - диоксигенил |
O 2 - - надпероксид |
|
PH 4 + - фосфоний |
O 3 - - озонид |
|
VO 2 + - ванадил |
OCN - - цианат |
|
UO 2 + - уранил |
OH - - гидроксид |
Для небольшого числа хорошо известных веществ также используют специальные названия:
|
AsH 3 - арсин |
HN 3 - азидоводород |
|
B 2 H 6 - боран |
H 2 S - сероводород |
|
B 4 H 10 - тетраборан(10) |
NH 3 - аммиак |
|
HCN - циановодород |
N 2 H 4 - гидразин |
|
HCl - хлороводород |
NH 2 OH - гидроксиламин |
|
HF - фтороводород |
PH 3 - фосфин |
|
HI - иодоводород |
SiH 4 - силан |
Гидроксиды - тип сложных веществ, в состав которых входят атомы некоторого элемента Е (кроме фтора и кислорода) и гидроксогруппы ОН; общая формула гидроксидов Е(ОН)
n , где n = 1÷6. Форма гидроксидов Е(ОН) n называется орто -формой; при n > 2 гидроксид может находиться также в мета -форме, включающей кроме атомов Е и групп ОН еще атомы кислорода О, например Е(ОН) 3 и ЕО(ОН), Е(ОН) 4 и Е(ОН) 6 и ЕО 2 (ОН) 2 .Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды.
Кислотные гидроксиды содержат атомы водорода, которые могут замещаться на атомы металла при соблюдении правила стехиометрической валентности. Большинство кислотных гидроксидов находится в мета -форме, причем атомы водорода в формулах кислотных гидроксидов ставят на первое место, например
H 2 SO 4 , HNO 3 и H 2 CO 3 , а не SO 2 (OH) 2 , NO 2 (OH) и CO(OH) 2 . Общая формула кислотных гидроксидов - Н х ЕО у , где электроотрицательную составляющую ЕО у х- называют кислотным остатком. Если не все атомы водорода замещены на металл, то они остаются в составе кислотного остатка.Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием “ая” и группового слова “кислота”. Приведем формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе):
|
кислотный гидроксид |
кислотный остаток |
|
HAsO 2 - метамышьяковистая |
AsO 2 - - метаарсенит |
|
H 3 AsO 3 - ортомышьяковистая |
AsO 3 3- - ортоарсенит |
|
H 3 AsO 4 - мышьяковая |
AsO 4 3- - арсенат |
| 4 О 7 2- - тетраборат | |
| iО 3 - - висмутат | |
|
HBrO - бромноватистая |
BrO - - гипобромит |
|
HBrO 3 - бромноватая |
BrO 3 - - бромат |
|
H 2 CO 3 - угольная |
CO 3 2- - карбонат |
|
HClO - хлорноватистая |
ClO - - гипохлорит |
|
HClO 2 - хлористая |
ClO 2 - - хлорит |
|
HClO 3 - хлорноватая |
ClO 3 - - хлорат |
|
HClO 4 - хлорная |
ClO 4 - - перхлорат |
|
H 2 CrO 4 - хромовая |
CrO 4 2- - хромат |
| CrO 4 - - гидрохромат | |
|
H 2 Cr 2 О 7 - дихромовая |
Cr 2 O 7 2- - дихромат |
|
FeO 4 2- - феррат |
|
|
HIO 3 - иодноватая |
IO 3 - - иодат |
|
HIO 4 - метаиодная |
IO 4 - - метапериодат |
|
H 5 IO 6 - ортоиодная |
IO 6 5- - ортопериодат |
|
HMnO 4 - марганцовая |
MnO 4 - - перманганат |
|
MnO 4 2- - манганат |
|
|
Mо O 4 2- - молибдат |
|
|
HNO 2 - азотистая |
NO 2 - - нитрит |
|
HNO 3 - азотная |
NO 3 - - нитрат |
|
HPO 3 - метафосфорная |
PO 3 - - метафосфат |
|
H 3 PO 4 - ортофосфорная |
PO 4 3- - ортофосфат |
| PO 4 2- - гидроортофосфат | |
| 2 PO 4 - - дигидроотофосфат | |
|
H 4 P 2 O 7 - дифосфорная |
P 2 O 7 4- - дифосфат |
|
ReO 4 - - перренат |
|
|
SO 3 2- - сульфит |
|
|
HSO 3 - - гидросульфит |
|
|
H 2 SO 4 - серная |
SO 4 2- - сульфат |
| SO 4 - - гидросульфат | |
|
H 2 S 2 O 7 - дисерная |
S 2 O 7 2- - дисульфат |
|
H 2 S 2 O 6 (O 2) - пероксодисерная |
S 2 O 6 (O 2) 2- - пероксодисульфат |
|
H 2 SO 3 S - тиосерная |
SO 3 S 2- - тиосульфат |
|
H 2 SeO 3 - селенистая |
SeO 3 2- - селенит |
|
H 2 SeO 4 - селеновая |
SeO 4 2- - селенат |
|
H 2 SiO 3 - метакремниевая |
SiO 3 2- - метасиликат |
|
H 4 SiO 4 - ортокремниевая |
SiO 4 4- - ортосиликат |
|
H 2 TeO 3 - теллуристая |
TeO 3 2- - теллурит |
|
H 2 TeO 4 - метателлуровая |
TeO 4 2- - метателлурат |
|
H 6 TeO 6 - ортотеллуровая |
TeO 6 6- - ортотеллурат |
|
VO 3 - - метаванадат |
|
|
VO 4 3- - ортованадат |
|
|
WO 4 3- - вольфрамат |
Менее распространенные кислотные гидроксиды называют по номенклатурным правилам для комплексных соединений, например:
Названия кислотных остатков используют при построении названий солей.
Основные гидроксиды содержат гидроксид-ионы, которые могут замещаться на кислотные остатки при соблюдении правила стехиометрической валентности. Все основные гидроксиды находятся в орто -форме; их общая формула М(ОН)
n , где n = 1,2 (реже 3,4) и М n +- катион металла. Примеры формул и названий основных гидроксидов:Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (реакция солеобразования ), например:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH) 2 + H 2 SO 4 = Ca 2 SO 4 (OH) 2 + 2H 2 O
Соли - тип сложных веществ, в состав которых входят катионы М
n + и кислотные остатки*.Соли с общей формулой М х (ЕО у
) n называют средними солями, а соли с незамещенными атомами водорода, - кислыми солями. Иногда соли содержат в своем составе также гидроксид - или(и) оксид - ионы; такие соли называют основными солями. Приведем примеры и названия солей:|
- ортофосфат кальция |
|
|
- дигидроортофосфат кальция |
|
|
- гидроортофосфат кальция |
|
|
Карбонат меди(II) |
|
|
Cu 2 CO 3 (OH) 2 |
- дигидроксид-карбонат димеди |
|
Нитрат лантана(III) |
|
|
- оксид-динитрат титана |
Кислые и основные соли могут быть превращены в средние соли взаимодействием с соответствующим основным и кислотным гидроксидом, например:
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = 2CaSO 4 + 2H 2 O
Встречаются также соли, содерхащие два разных катиона: их часто называют двойными солями
, например:
Оксиды Е х О у
- продукты полной дегидратации гидроксидов:Кислотным гидроксидам
(H 2 SO 4 , H 2 CO 3) отвечают кислотные оксиды (SO 3 , CO 2), а основным гидроксидам (NaOH, Ca(OH) 2) - основные оксиды (Na 2 O, CaO), причем степень окисления элемента Е не изменяется при переходе от гидроксида к оксиду. Пример формул и названий оксидов:Кислотные и основные оксиды сохраняют солеобразующие свойства соответствующих гидроксидов при взаимодействии с противоположными по свойствам гидроксидами или между собой:
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
Амфотерность
(а ) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(б ) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных
гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидам и оксидом, образуя соответствующую соль -
сульфат алюминия Если указанные реакции протекают в водном растворе, то состав образующихся солей меняется, но присутствие алюминия в катионе и анионе остаётся:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH) 3 + NaOH = Na
Здесь квадратными скобками выделены комплексные ионы Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными, к ним относятся элементы А-групп Периодической системы -
Амфотерные гидроксиды (если степень окисления элемента превышает +
II) могут находиться в орто - или (и) мета - форме. Приведем примеры амфотерных гидроксидов:Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды, например:
Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента - металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элемента - неметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца(
II) доминируют основные свойства, а сам марганец входит в состав катионов типа [ Mn(H 2 O) 6 ] 2+ , тогда как у оксида и гидроксида марганца(VII) доминируют кислотные свойства, а сам марганец входит в состав аниона типа MnO 4 - . Амфотерным гидроксидам с большим преобладанием кислотных свойств приписывают формулы и названия по образцу кислотных гидроксидов, например Н Mn VII O 4 - марганцовая кислота.Таким образом, деление элементов на металлы и неметаллы - условное; между элементами (
Na, K, Ca, Ba и др.) с чисто металлическими и элементами (F, O, N, Cl, S, C и др.) с чисто неметаллическими свойствами существует большая группа элементов с амфотерными свойствами.Обширный тип неорганических сложных веществ - бинарные соединения. К ним относятся, в первую очередь все двухэлементные соединения (кроме основных, кислотных и амфотерных оксидов), например
H 2 O, KBr, H 2 S, Cs 2 (S 2), N 2 O, NH 3 , HN 3 , CaC 2 , SiH 4 . Электроположительная и электроотрицательная составляющие формул этих соединений включают отдельные атомы или связанные группы атомов одного элемента.Многоэлементные вещества, в формулах которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения, например
CSO, IO 2 F 3 , SBrO 2 F, CrO(O 2) 2 , PSI 3 , (CaTi)O 3 , (FeCu)S 2 , Hg(CN) 2 , (PF 3) 2 O, VCl 2 (NH 2 ). Так, CSO можно представить как соединение CS 2 , в котором один атом серы заменен на атом кислорода.Названия бинарных соединений строятся по обычным номенклатурным правилам, например:
|
OF 2 - дифторид кислорода |
K 2 O 2 - пероксид калия |
|
HgCl 2 - хлорид ртути(II) |
Na 2 S - сульфид натрия |
|
Hg 2 Cl 2 - дихлорид диртути |
Mg 3 N 2 - нитрид магния |
|
SBr 2 O - оксид-дибромид серы |
NH 4 Br - бромид аммония |
|
N 2 O - оксид диазота |
Pb(N 3) 2 - азид свинца(II) |
|
NO 2 - диоксид азота |
CaC 2 - ацетиленид кальция |
Для некоторых бинарных соединений используют специальные названия, список которых был приведен ранее.
Химические свойства бинарных соединений довольно разнообразны, поэтому их часто разделяют на группы по названию анионов, т.е. отдельно рассматривают галогениды, халькогениды, нитриды, карбиды, гидриды и т. д. Среди бинарных соединений встречаются и такие, которые имеют некоторые признаки других типов неорганических веществ. Так, соединения
CO, NO, NO 2 , и (Fe II Fe 2 III)O 4 , названия которых строятся с применением слова оксид, к типу оксидов (кислотных, основных, амфотерных) отнесены быть не могут. Монооксид углерода СО, монооксид азота NO и диоксид азота NO 2 не имеют соответствующих кислотных гидроксидов (хотя эти оксиды образованы неметаллами С и N), не образуют они и солей, в состав анионов которых входили бы атомы С II , N II и N IV . Двойной оксид (Fe II Fe 2 III)O 4 - оксид дижелеза(III)-железа(II) хотя и содержит в составе электроположительной составляющей атомы амфотерного элемента - железа, но в двух разных степенях окисления, вследствие чего при взаимодействии с кислотными гидроксидами образует не одну, а две разные соли.Такие бинарные соединения, как
AgF, KBr, Na 2 S, Ba(HS) 2 , NaCN, NH 4 Cl, и Pb(N 3) 2 , построены, подобно солям, из реальных катионов и анионов, поэтому их называют солеобразными бинарными соединениями (или просто солями). Их можно рассматривать как продукты замещения атомов водорода в соединениях Н F, Н Cl, Н Br, Н 2 S, Н CN и Н N 3 . Последние в водном растворе обладают кислотной функцией, и поэтому их растворы называют кислотами, например Н F(aqua) - фтороводородная кислота, Н 2 S(aqua) - сероводородная кислота. Однако они не принадлежат к типу кислотных гидроксидов, а их производные - к солям в рамках классификации неорганических веществ.