Substancje według intensywności barwy roztworów (dokładniej przez absorpcję światła przez roztwory).
Podstawowe informacje
Jeden z pierwszych kolorymetrów, stworzony przez francuskiego optyka Julesa Dubosc, 1880.
Kolorymetria to metoda ilościowego oznaczania zawartości substancji w roztworach, wizualnie lub przy użyciu przyrządów takich jak kolorymetry.
Kolorymetrię można zastosować do ilościowego określenia wszystkich substancji, które tworzą kolorowe roztwory lub mogą w wyniku reakcji chemicznej wytworzyć barwny rozpuszczalny związek. Metody kolorymetryczne polegają na porównaniu intensywności barwy roztworu badawczego, badanego w świetle przechodzącym, z barwą roztworu wzorcowego zawierającego ściśle określoną ilość tej samej barwnej substancji lub z wodą destylowaną.
Ciekawa jest historia powstania kolorymetrii i fotometrii. Yu. A. Zołotow wspomina, że Robert Boyle (a także niektórzy naukowcy przed nim) stosowali ekstrakt z orzechów garbnikowych w celu rozróżnienia żelaza i miedzi w roztworze. Jednak najwyraźniej to Boyle jako pierwszy zauważył, że im więcej żelaza jest w roztworze, tym intensywniejszy jest jego kolor. Był to pierwszy krok w stronę kolorymetrii. A pierwszymi przyrządami kolorymetrycznymi były kolorymetry, takie jak kolorymetr Dubosc (1870), który był używany do niedawna.
Fotokolorymetry i spektrofotometry mierzą przepuszczalność światła przy określonej długości fali światła. Do kalibracji urządzenia stosuje się kontrolę (zwykle wodę destylowaną lub materiał wyjściowy bez dodanych odczynników).
Kolorymetria znajduje szerokie zastosowanie w chemii analitycznej, m.in. w analizach hydrochemicznych, w szczególności do ilościowej analizy zawartości składników pokarmowych w wody naturalne, do pomiarów, w medycynie, a także w przemyśle do kontroli jakości produktów.
Fotokolorymetria
Fotokolorymetria- ilościowe oznaczanie stężenia substancji poprzez absorpcję światła w zakresie widzialnym i bliskim ultrafioletu widma. Absorpcję światła mierzy się za pomocą fotokolorymetrów lub spektrofotometrów.
Notatki
Fundacja Wikimedia. 2010.
Zobacz, co oznacza „Kolorymetria (metoda chemiczna)” w innych słownikach:
Nie mylić z kalorymetrią. Kolorymetria (od łacińskiego koloru koloru i greckiej miary μετρεω): Kolorymetria (nauka) to nauka o mierzeniu koloru. Metoda kolorymetryczna (metoda chemiczna). Analiza chemiczna... Wikipedii
Bada związki pomiędzy składem a właściwościami makroskopowymi. systemy składające się z kilku inicjał w (komponentach). Dla F.x. A. Typowe jest przedstawienie tych zależności w formie graficznej, w formie diagramu składu i właściwości; używane są również stoły... ... Encyklopedia chemiczna
Spis treści... Wikipedia
Termin ten ma inne znaczenia, patrz Chemia (znaczenia). Chemia (z arabskiego کيمياء, prawdopodobnie wywodzące się od egipskiego słowa km.t (czarny), od którego pochodzi również nazwa Egiptu, czarnoziemu i ołowiu „czarny”... ... Wikipedia
W Wikisłowniku znajduje się wpis dotyczący „chemii organicznej” Chemia organiczna sekcja chemii, która studiuje wspólnie... Wikipedia
Termin ten ma inne znaczenia, patrz Biochemia (znaczenia). Biochemia (chemia biologiczna lub fizjologiczna) to nauka o składzie chemicznym żywych komórek i organizmów procesy chemiczne, leżące u podstaw ich działalności życiowej.... ...Wikipedia
- (z innego greckiego γῆ „Ziemia” i z λόγος „nauczanie”) nauka o składzie, strukturze i wzorach rozwoju Ziemi i innych planet Układ Słoneczny i ich naturalne satelity. Spis treści 1 Historia geologii… Wikipedia
Praca społeczna działalność zawodowa w sprawie organizowania pomocy i wzajemnej pomocy osobom i grupom znajdującym się w trudnej sytuacji sytuacje życiowe, ich rehabilitację psychospołeczną i integrację. W swojej najbardziej ogólnej formie praca socjalna reprezentuje... ... Wikipedię
Ogólne warunki- Terminy rubrykowe: Warunki ogólne Absolutne ciało doskonale czarne Absolutne minimum Absolutny wskaźnik wykorzystania zasobów i oszczędzania zasobów ... Encyklopedia terminów, definicji i objaśnień materiałów budowlanych
Ten artykuł lub sekcja wymaga rewizji. Prosimy o poprawienie artykułu zgodnie z zasadami pisania artykułów. Chemia kwantowa to kierunek... Wikipedia
Kolorymetria jest jedną z najbardziej znanych proste metody analiza absorpcji. Polega na zmianie odcienia barwy roztworu badawczego w zależności od stężenia. Metody kolorymetryczne można podzielić na kolorymetria wizualna I fotokolorymetria.
Kolorometria wizualna
Odbywa się to poprzez standardowe serie. W tym celu roztwór testowy porównuje się z zestawem roztworów wzorcowych, które muszą być świeżo przygotowane i różnić się od siebie co najmniej 10-15%.
Na przykład kolorymetryczne oznaczanie pH według Alyamovsky'ego opiera się na właściwości wskaźników zmiany koloru w zależności od stężenia jonów wodorowych obecnych w roztworze.
Skala urządzenia Alyamovsky'ego to seria zapieczętowanych probówek wypełnionych kolorowym roztworem. Ten światłostabilny roztwór imituje barwę uniwersalnego wskaźnika przy określonej wartości pH. Roztwór testowy porównuje się ze skalą i znajduje się w nim probówka, która najbardziej odpowiada mu kolorem. Jeżeli kolor cieczy nie odpowiada kolorowi roztworów na skali, należy przyjąć średnią wartość z dwóch probówek o podobnym kolorze. Czasami można natknąć się na zestaw Alyamovsky'ego, w którym standardową skalę kolorów reprezentują nie ampułki z roztworami, ale szklane płytki z kolorowymi foliami.
Dla ułatwienia porównania do urządzenia dołączony jest komparator, jednak technika porównywania rozwiązań ze skalą w tym przypadku jest inna. Probówkę z kolorowym roztworem testowym należy umieścić w lewym gnieździe komparatora. Z prawego gniazda komparatora do probówki wlewa się 5 ml wody destylowanej. W rowki komparatora wprowadza się standardową skalę kolorów, a jej kolorowa część powinna znajdować się naprzeciw probówki z wodą destylowaną, a bezbarwna część powinna znajdować się naprzeciw roztworu testowego. Komparator bierze się lewą ręką i podnosi do poziomu oczu, trzymając skalę od siebie i obracając ją w stronę światła. Przesuwając skalę standardową w górę i w dół, znajdź jej część odpowiadającą kolorowi roztworu testowego. Zwracając skalę porównawczą do siebie, odczytaj wartość pH i zapisz wynik analizy.
Fotokolorymetria
Metody fotokolorymetryczne są jednym z powszechnie stosowanych rodzajów analizy absorpcji optycznej. Aby dokładniej określić analizowany pierwiastek, stosuje się specjalne urządzenia - kolorymetry fotoelektryczne (PEC).
Podczas pracy z FEC najczęściej wykorzystuje się metodę krzywej kalibracyjnej, polegającą na konstruowaniu wykresu kalibracyjnego w osiach „gęstość optyczna – stężenie” dla roztworów wzorcowych o znanym stężeniu. Po zmierzeniu gęstości optycznej analizowanego roztworu, z wykresu odczytuje się jego stężenie. Aby lepiej przyswoić sobie metodę fotokolorymetryczną, studenci proszeni są o przeprowadzenie analizy laboratoryjnej oznaczania jonów miedzi i niklu w roztworze tą metodą na KFK-3-01.
Laboratorium 1
OZNACZANIE JONÓW METALI CIĘŻKICH W ROZTWORZE METODĄ FOTOKOLORYMETRYCZNĄ
Cel pracy: nauczy się obsługi fotokolorymetru KFK-3-01. Oznacz zawartość jonów metali ciężkich w KFK-3-01.
Procedura obsługi fotometru KFK-3-01.
Zamknąć pokrywę komory na kuwety. Włącz przełącznik „Sieć”. Po 30 minutach rozpocznij pracę. Ustaw wymaganą długość fali.
- 1. Ustawianie długości fal musi odbywać się poprzez przejście z krótkich fal na dłuższe. Jeśli podczas instalacji wartość długości fali przekroczy wymaganą, należy przywrócić 20-30 Nm krótszym falom i ponownie ustawić wymaganą wartość.
- 2. Weź dwie kuwety. Do jednego wlać wodę destylowaną, do drugiego roztwór testowy. Kuwety są napełnione do oznaczenia z boku. Na zewnętrznej powierzchni kuwety nie powinno być żadnych kropel.
- 3. Umieść kuwety w komorze na kuwety. Umieścić kuwetę z „ślepą próbką” w odległym gnieździe uchwytu kuwety. Ustaw uchwyt ruchu kuwety w skrajnie lewym położeniu. Zamknąć pokrywę komory na kuwety.
- 4. Użyj klawisza „D” lub „C”, aby wybrać tryb pomiaru. Naciśnij klawisz „#”. Na dolnym wskaźniku, w górnej linii, po 3-5 sekundach zostanie zapisany „Graduation”. Napis zniknie i pojawi się „Zmień”, a w dolnej linii pojawi się wynik pomiaru. Ustawić pokrętło ruchu kuwety w prawo. Wynik pomiaru (gęstość optyczna roztworu testowego) pojawi się w dolnej linii.
Zadanie 1. Oznaczanie zawartości Cu++ w roztworze metodą fotokolorymetryczną.
Sprzęt i odczynniki: fotometr KFK-3-01, kuweta 3 cm, kolby miarowe o pojemności 50 ml, pipety 5,10 ml, roztwór wzorcowy Cu++ - 0,5 mg/ml, roztwór amoniaku 1:1.
Technika eksperymentalna
1. Wybór długości fali.
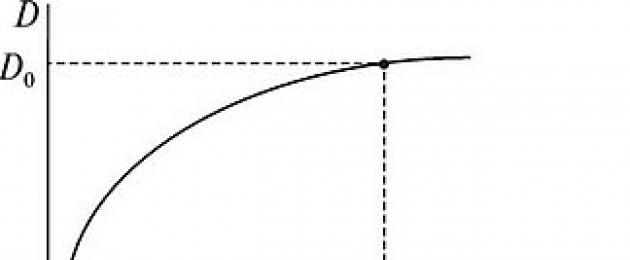
Do kolby miarowej o pojemności 50 ml dodać 14 ml mianowanego roztworu Cu+2, dodać 15 ml amoniaku i uzupełnić wodą do kreski. Wymieszaj i zmierz gęstość optyczną roztworu /) na podstawie długości fali X. Wypełnij tabelę. 1. Długość fali przyjmuje się jako optymalną X 0, przy którym wartość gęstości optycznej jest maksymalna dla danego rozwiązania (rys. 1).
Ryż. 1. Zależność gęstości optycznej mi od długości fali X
2.
W kolbach miarowych o pojemności 50 ml przygotować 5-6 roztworów Cu - ^ o różnej zawartości od 1 do 7 mg/ml. Objętość każdego roztworu wynosi 15 ml. Do każdej kolby dodać 15 ml amoniaku i dopełnić wodą do kreski. Mieszaj i mierz gęstość optyczną I na wybranej długości fali X 0 . Wypełnij tabelę. 2 i wykreśl zależność gęstości optycznej?) od stężenia roztworu C (ryc. 2).

3. Oznaczanie zawartości Cu +2 w roztworze kontrolnym.
Do kolby z roztworem kontrolnym dodać 10 ml wody i 15 ml amoniaku. Doprowadź wodę do kreski i wymieszaj. Zmierzyć gęstość optyczną roztworu. Korzystając z wykresu kalibracyjnego (rys. 2) oznaczyć C0 - zawartość Cu +2 w roztworze.
4. Wyciągnij wnioski z pracy.
Zadanie 2. Oznaczanie zawartości Na+2 w roztworze metodą fotokolorymetryczną.
Sprzęt i odczynniki: fotometr KFK-3-01, kuweta 3 cm, kolby miarowe 50 ml, pipety 5,10 ml, roztwór wzorcowy 1Ch1 ++ - 0,01 mg/ml, 1% alkoholowy roztwór dimetyloglioksymu, woda jodowana, roztwór amoniaku 1:1.
Technika eksperymentalna
1. Wybór długości fali.
Do kolby miarowej o pojemności 50 ml dodać 10 ml roztworu mianowanego nr 5, dodać 5 ml wody jodowanej, 6 ml amoniaku i 2 ml dimetyloglioksymu. Dopełnij wodą do kreski, zamieszaj. Po 5-7 minutach zmierzyć gęstość optyczną roztworu przy różnych długościach fal. Wypełnij tabelę. 1. Wykreśl zależność gęstości optycznej roztworu od długości fali X. Optymalna długość fali wynosi 7,0, przy której gęstość optyczna jest maksymalna dla danego rozwiązania (patrz rys. 1).
2. Budowa wykresu kalibracyjnego.
W kolbach miarowych o pojemności 50 ml przygotować 5-6 roztworów nr +2 o różnej zawartości od 0,01 do 0,1 mg/ml. Objętość każdego roztworu wynosi 10 ml. Następnie dodać odczynniki do każdej kolby zgodnie z opisem w kroku 1. Napełnić wodą do kreski i wymieszać. Po 5-7 minutach zmierzyć gęstość optyczną roztworu przy wybranej długości fali. Wypełnij tabelę. 2 i wykreśl zależność gęstości optycznej O na stężenie roztworu C (patrz ryc. 2).
3. Definicja treści № +2 w roztworze kontrolnym.
Do kolby z roztworem kontrolnym dodać 10 ml wody, a następnie dodać odczynniki zgodnie z pkt. 1. Zmierzyć /) 0 - gęstość optyczna roztworu. Korzystając z wykresu kalibracyjnego (ryc. 3) C (), określ C 0 - zawartość nr +2 w roztworze.
4. Wyciągnij wnioski na temat pracy.
Tabela 1
(Filin V.A. Ekologia wideo. Co jest dobre dla oka, a co złe. M.: Wideoekologia, 1997).
Metody analizy polegające na porównaniu intensywności barwy roztworu badawczego i roztworu o określonym stężeniu - standardowego - nazywane są kolorymetrią (kolorymetrią). Rozróżnia się kolorymetrię wizualną, przeprowadzaną za pomocą oka obserwatora, i kolorymetrię fotoelektryczną, przeprowadzaną za pomocą fotokomórki.
Jeżeli przez warstwę roztworu przejdzie wiązka światła o natężeniu I0, to po przejściu przez tę warstwę natężenie światła zmniejszy się do It. Równanie podstawowej zasady kolorymetrii – prawa Bouguera-Lamberta-Beera – ma następującą postać:
![]()
gdzie Jest to natężenie strumienia światła po przejściu przez roztwór o stężeniu C i grubości warstwy l; I0 to natężenie padającego strumienia światła; g jest współczynnikiem zależnym od długości fali padającego światła, rodzaju substancji rozpuszczonej i temperatury roztworu; współczynnik g nazywany jest molowym współczynnikiem ekstynkcji. Stosunek natężenia strumienia światła przechodzącego przez rozwiązanie To do natężenia padającego strumienia światła I0 nazywany jest przepuszczalnością lub przezroczystością i jest oznaczony literą T:

Wartość T w odniesieniu do grubości warstwy wynoszącej 1 cm nazywa się współczynnikiem przepuszczalności. Logarytm odwrotności transmitancji nazywany jest ekstynkcją E lub gęstością optyczną D:

W konsekwencji ekstynkcja E jest wprost proporcjonalna do stężenia substancji w roztworze. Jeśli przedstawimy graficznie zależność ekstynkcji od stężenia, wykreślając stężenie wzdłuż osi odciętych i ekstynkcję wzdłuż osi rzędnych, otrzymamy linię prostą biegnącą od początku współrzędnych (ryc. 52).

Taki wykres pozwala na wyciągnięcie wniosku o możliwości zastosowania podstawowych zasad kolorymetrii do badanych roztworów. Jeśli rozwiązanie jest zgodne z tym prawem, wówczas wykres przedstawiający zależność spłaty; na stężenie będzie reprezentowane przez linię prostą. Jeśli rozwiązanie nie jest zgodne z tym prawem, wówczas prostość zostaje naruszona w części krzywej lub na całej jej długości.
Metody kolorymetrii wizualnej
Kolorymetrię wizualną przeprowadza się jedną z następujących metod: 1) metoda serii standardowych; 2) metoda miareczkowania kolorymetrycznego lub metody powielania; 3) metoda wyrównywania kolorów. Pierwsze dwa z nich nie wymagają przestrzegania podstawowego prawa kolorymetrii; metoda wyrównywania kolorów wymaga, aby roztwory przestrzegały podstawowych praw kolorymetrii.

Standardowa metoda szeregowa
Istota metody. W przypadku kolorymetrii metodą szeregów wzorcowych roztwór badany w warstwie o określonej grubości porównuje się z zestawem roztworów wzorcowych o tej samej grubości warstwy, różniących się od siebie intensywnością barwy o około 10-15%. Nieznane stężenie jest równe stężeniu roztworu wzorcowego, którego barwa pokrywa się z barwą badanego roztworu lub znajduje się pomiędzy dwoma najbliższymi, słabszymi lub silniej zabarwionymi. Do oznaczania zawartości aldehydów, oleju fuzlowego i alkoholu metylowego w rektyfikowanym alkoholu można zastosować standardową metodę szeregową. Barwę porównuje się w probówkach ze szlifowanymi korkami o tej samej średnicy, wykonanymi ze szkła bezbarwnego o tej samej grubości. Probówki kolorymetryczne umieszcza się w specjalnym stojaku (ryc. 53) i na tle matowego szkła lub kartki białego papieru porównuje się barwę badanego roztworu z barwą roztworów wzorcowych. W przypadku probówek z płaskim dnem kolory można porównać oglądając roztwory z góry. Jest to szczególnie wygodne podczas pracy z jasnokolorowymi roztworami.
1) mianowane roztwory alkoholu izoamylowego zawierające 0,0005; 0,001; 0,002 i 0,003% obj. w 96% alkoholu etylowym, nie zawiera oleju fuzlowego i aldehydów;
2) 0,05% roztwór paradimetyloaminobenzaldehydu w stężonym x. części kwasu siarkowego o gęstości względnej 1,835.
Postęp analizy. Odmierzyć pipetą miarową o pojemności 1 ml 0,5 ml badanego alkoholu i umieścić go w czystej, suchej, płaskodennej kolbie z długą szyjką, do której z cylindra miarowego dodaje się 10 ml roztworu paradimetyloaminobenzaldehydu. Zawartość miesza się, kolbę zanurza się we wrzącej wodzie. kąpiel wodna i gotuj wodę przez dokładnie 20 minut. Jako łaźnię wodną stosuje się zlewkę szklaną o pojemności 300 ml. Podczas gotowania szyjka kolby powinna znajdować się w pozycji pochylonej. Po 20 minutach kolbę szybko schładza się pod bieżącą wodą. W tym przypadku zawartość kolby nabiera jasnożółto-różowego zabarwienia, przechodzącego w róż o różnej intensywności w zależności od zawartości oleju fuzlowego.
Zawartość kolby wlewa się do probówki ze szlifowanym korkiem. Barwę badanego alkoholu porównuje się z barwą roztworów wzorcowych poddanych takiej samej obróbce jak alkohol testowy. Dopasowując kolory, określa się zawartość oleju fuzlowego w badanym alkoholu.
Kolorymetryczna metoda miareczkowania
W metodzie miareczkowania kolorymetrycznego pewną objętość badanego barwnego roztworu o nieznanym stężeniu porównuje się z tą samą objętością wody, do której dodaje się barwny roztwór wzorcowy o określonym stężeniu. Dodawaj roztwór z biurety (miareczkuj), aż kolor zrówna się z roztworem testowym. W technochemicznej kontroli instalacji fermentacyjnych metodę tę stosuje się do określenia barwy piwa, wyrażanej w mililitrach 0,1 N. roztwór jodu dodany do 100 ml wody destylowanej w celu wyrównania koloru 100 ml piwa. Postęp. Określenie to przeprowadza się w następujący sposób. Dwie identyczne zlewki o pojemności 150-200 ml umieszcza się na kartce białego papieru lub na białym talerzu porcelanowym. Do jednego wlewa się 100 ml piwa, do drugiego 100 ml wody destylowanej. 0,1 N wlewa się do szklanki wody z biurety, mieszając. roztworem jodu, aż kolor cieczy stanie się taki sam, patrząc zarówno z góry, jak i z boku (przez ciecz).
Metoda wyrównywania kolorów
Wyobraźmy sobie, że istnieją dwa kolorowe roztwory zawierające tę samą barwną substancję, ale w różnych stężeniach. Ekstynkcja każdego z rozwiązań będzie odpowiednio równa
Zmieniając grubość warstwy tych roztworów (l), można osiągnąć stan, w którym pomimo różnych stężeń natężenie strumienia świetlnego przechodzącego przez oba roztwory będzie takie samo – nastąpi równowaga optyczna. Stanie się tak, gdy oba roztwory pochłoną tę samą frakcję światła, tj. gdy spłaty rozwiązań są równe; w tym przypadku E1 = E2 i eC1l1 = eC2l2. Współczynnik ekstynkcji e obu roztworów jest taki sam (roztwór zawiera tę samą substancję). Stąd,
![]()

te. Grubość warstw roztworów o tej samej zaobserwowanej barwie jest odwrotnie proporcjonalna do stężeń roztworów. Ta zależność między grubością warstwy a stężeniem jest podstawą metody wyrównywania kolorów.

Wyrównanie kolorów przeprowadza się w specjalnych urządzeniach - kolorymetrach. Kolorymetr zanurzeniowy systemu Duboscq jest bardzo powszechny. Konstrukcja optyczna tego kolorymetru jest następująca (ryc. 54). Strumień światła ze zwierciadła 1 przechodzi przez warstwę roztworu badawczego w kuwecie 2, immersirze 4, pryzmacie 6, soczewkach 8 i 9 i wchodzi do okularu oświetlając prawą połowę pola optycznego. Kolejny strumień światła przechodzi przez warstwę roztworu wzorcowego w kuwecie 3, immersirze 5, pryzmacie 7, soczewkach 8 i 9 i wchodzi do okularu oświetlając lewą połowę pola optycznego. Zmieniając wysokości kolumn roztworu za pomocą grzechotek, osiąga się równowagę optyczną - zanik granicy faz. Formularz ogólny kolorymetr pokazano na ryc. 55.

Barwę napojów alkoholowych określa się za pomocą barwomierza, czyli kolorymetru zanurzeniowego typu Dubosque, w którym jedną z kuwet zastąpiono ramką, na której umieszczony jest odpowiedni suchy wzorzec barwy. Standardy jednolitego koloru to folia octanowa malowana trwałymi barwnikami chemicznymi.
Aby zmierzyć kolor badanego produktu, po przefiltrowaniu wlewa się go do kuwety 1 miernika koloru (ryc. 56), a odpowiedni standard 2 umieszcza się na specjalnym stojaku Promienie świetlne po przejściu przez kuwetę z roztwór testowy i wzorzec koloru, przez pryzmaty 3 i 4 wprowadź do komory 5 dwa pryzmaty, które kierują promienie światła do teleskopu 6. W teleskopie obserwuje się pole, którego połowa jest oświetlana przez wiązkę przechodzącą przez produkt w trakcie studiów. Jednolitą kolorystykę obu segmentów pola uzyskujemy poprzez podniesienie lub opuszczenie kuwety 1 za pomocą grzechotki.
Po wyrównaniu barw w obu segmentach pola widzenia, na skali przyrządu mierzy się wysokość słupa cieczy w milimetrach i porównuje z wysokością słupka dopuszczoną dla danego produktu. Tak dla Likier pomarańczowy stosuje się normę nr 7, wysokość kolumny na skali miernika barwy powinna wynosić 33 mm, dla likieru czekoladowego - norma nr 14, wysokość kolumny wynosi 26 mm. Dane określone dla wszystkich napojów alkoholowych podane są w instrukcjach kontroli techniczno-chemicznej produkcji napojów alkoholowych. Jeżeli otrzymane liczby są równe lub różnią się o ±5, uznaje się, że kolor badanego produktu odpowiada zatwierdzonej próbce. Jeśli uzyskana wysokość jest większa od zatwierdzonej, produkt jest podmalowany, jeśli jest mniejszy, to zostaje przemalowany.
Zestaw standardów zawiera bezbarwne filtry kompensacyjne, które służą do zrównania naturalnej jasności kolorów niektórych produktów z jasnością koloru filtra barwnego. Kompensator umieszcza się na otworze świetlnym miernika barwy pod kuwetą z produktem.
Metoda fotokolorymetryczna
Metodę tę opisano w rozdziale książki „Technochemiczna kontrola suszenia warzyw i produkcji koncentratów spożywczych”.
Kolorymetryczne oznaczanie zawartości węglowodanów w półproduktach produkcji alkoholu (metoda VNIISL)
Odczynnikiem do oznaczania metodą kolorymetryczną zawartości węglowodanów w półproduktach produkcji alkoholu jest roztwór antronu w x. części kwasu siarkowego o gęstości względnej 1,830 (stężenie 0,2% wag.). W silnie kwaśnym środowisku glukoza rozkłada się, tworząc pochodne furfuralu, które reagują z antronem, tworząc zielony związek kompleksowy. Ta metoda określa całkowita ilość węglowodanów, a dane uzyskano w jednostkach glukozy. Wstępna hydroliza polisacharydów do glukozy nie jest wymagana, ponieważ reakcja z antronem zachodzi w środowisku silnie kwaśnym; w tym przypadku polisacharydy ulegają hydrolizie do monosacharydów, które reagują z antronem.

Aby oznaczyć zawartość węglowodanów, należy skonstruować krzywą kalibracyjną przy użyciu roztworów x. w tym glukoza o stężeniu 5-10 mg/100 ml (ryc. 59). Krzywą kalibracji buduje się w następujący sposób. Przygotuj rozwiązania x. w tym glukoza o stężeniu od 5 do 10 mg w 100 ml roztworu na każdy miligram. Następnie do probówki ze szkła żaroodpornego o pojemności 20 ml wlewa się 5 ml odczynnika i ostrożnie dodaje 2,5 ml przygotowanego roztworu glukozy, tak aby utworzyły się dwie warstwy. Probówkę zamyka się szlifowanym korkiem, szybko miesza zawartość i umieszcza probówkę we wrzącej łaźni wodnej na 6 minut. Po tym czasie probówkę wyjmuje się z kąpieli, mieszaninę reakcyjną schładza się do temperatury 20°C i barwny roztwór kolorymetryzuje w fotokolorymetrze przy użyciu filtra świetlnego o długości fali światła 610 nm i kuwety o długości boku 610 nm. 5 mm. Pomiary rozpoczyna się od najbardziej stężonego roztworu (w tym przykładzie 10 mg glukozy w 100 ml roztworu). Gęstość optyczną mierzy się za pomocą lewego bębna. Po zmierzeniu gęstości optycznej wszystkich roztworów konstruuje się krzywą kalibracyjną, nanosząc znane stężenia na osi odciętych, a odpowiadające im gęstości optyczne na osi rzędnych. Jak widać z poniższej krzywej (patrz ryc. 59), gęstość optyczna wzrasta proporcjonalnie do stężenia glukozy w roztworze. Zależność tę wyraża się linią prostą.
W celu oznaczenia węglowodanów roztwór testowy rozcieńcza się do zawartości 5-10 mg w 100 ml roztworu i oznaczanie przeprowadza się w następujący sposób: do probówki wlewa się 5 ml mieszaniny reakcyjnej, następnie 2,5 ml roztwór testowy dodaje się ostrożnie, tak aby utworzyły się dwie warstwy. W przyszłości postępuj jak przy konstruowaniu krzywej kalibracyjnej. Po wyznaczeniu gęstości optycznej D za pomocą linii kalibracyjnej, znajdź zawartość glukozy w roztworze. Zawartość glukozy w roztworze można również obliczyć za pomocą równania
![]()
które jest równaniem linii kalibracyjnej i jest kompilowane zgodnie ze współrzędnymi tej linii.
Zazwyczaj gęstość optyczną określa się w kuwecie o długości czołowej 5 mm. Jeżeli roztwór glukozy będzie bardzo stężony, to po reakcji z antronem powstały roztwór będzie zbyt intensywnie zabarwiony, którego gęstość optyczna będzie większa niż maksymalna gęstość optyczna bębna fotokolorymetru i nie będzie można określić jej wartości; w przypadku silnie rozcieńczonego roztworu glukozy wartość gęstości optycznej będzie niewielka, a błąd oznaczenia znaczny. W obu przypadkach analizę należy powtórzyć, odpowiednio zmieniając rozcieńczenie roztworu. Można również, bez powtarzania analizy, określić gęstość optyczną za pomocą innej kuwety podczas kolorymetrii: dla roztworów silnie zabarwionych o długości boku 3 lub 1 mm, dla roztworów słabo zabarwionych - 10 lub 20 mm. Po uzyskaniu gęstości optycznej w innych kuwetach nie ma możliwości określenia zawartości glukozy za pomocą linii kalibracyjnej sporządzonej w stosunku do kuwety o długości boku 5 mm. Należy najpierw obliczyć gęstość optyczną roztworu, którą uzyskuje się na tej długości krawędzi kuwety zgodnie z równaniem

gdzie D5 jest gęstością optyczną roztworu otrzymanego przy użyciu kuwety o długości czołowej 5 mm; Dx to gęstość optyczna roztworu otrzymanego w kuwecie o długości czołowej 1 mm.
Metodę tę można zastosować do roztworów zawierających reszty glukozy, w których nie występują pentozy i pentozany.
Oznaczanie zawartości rozpuszczalnych węglowodanów niesfermentowanych w dojrzałym puree ziemniaczanym (metoda VNIISL)
Dojrzały puree ziemniaczane oprócz węglowodanów przekształcalnych w alkohol (skrobia, dekstryny, maltoza, glukoza) zawiera także pentozy i pentozany, które nie ulegają przemianie w alkohol. Przy ustalaniu metoda chemiczna znajdź całkowitą ilość węglowodanów. Tymczasem bardzo ważna jest znajomość zawartości w zacierze węglowodanów ulegających fermentacji, które mogły zostać poddane fermentacji, ale nie uległy fermentacji na skutek niepełnego scukrzania i fermentacji – tzw. węglowodanów niesfermentowanych. Do niedawna wyznaczano je na podstawie różnicy pomiędzy całkowitą ilością węglowodanów i pentoz; Oznaczanie pentoz (patrz strona 82) jest stosunkowo trudne i czasochłonne. Analiza kolorymetryczna umożliwia bezpośrednie oznaczenie w zacierze węglowodanów niesfermentowanych.
Wiadomo, że antron zabarwia wszystkie węglowodany, w tym pentozy. Jednakże reakcja antronowa jest około 12 razy mniej czuła w oznaczaniu pentoz niż w analizie heksoz. VNIISL opracował nową modyfikację metody antronowej, która eliminuje wpływ pentoz i pentozanów na wyniki analizy. Modyfikacja ta opiera się na następującym prawie kolorymetrii: gęstość optyczna mieszaniny składników jest równa sumie iloczynów współczynników ekstynkcji poszczególnych składników i ich stężenia
gdzie D jest gęstością optyczną mieszaniny, równą log0/l. Tutaj l0 jest intensywnością źródła światła; l jest natężeniem światła przechodzącego przez roztwór; e1, e2, ..., en - współczynniki spłaty;
Tutaj D jest gęstością optyczną składnika, C jest stężeniem składnika w roztworze, l jest długością czoła kuwety.
Gęstość optyczna roztworu zależy od długości fali. Przy opracowywaniu metody wybrano dwie fale. W jednym z nich pierwszy składnik (glukoza) ma intensywne pasmo, natomiast drugi (arabinoza) wchłania się bardzo słabo. Przy innej długości fali obraz powinien być odwrotny. Na podstawie przeprowadzonych badań do kolorymetrii wybrano filtry o długości fali światła 610 i 413 nm.
Oznaczanie zawartości węglowodanów niesfermentowanych w zacierze przeprowadza się w następujący sposób. Odważyć w szklance próbkę filtratu zacieru o masie 25 g i przenieść do kolby miarowej o pojemności 200 ml. Szkło płucze się wodą i do tej samej kolby wlewa się wodę do mycia. Następnie do kolby dodać 2 ml 30% roztworu siarczanu cynku dla sklarowania, wymieszać, odstawić na 2-3 minuty, dodać 2 ml 15% roztworu soli żółtej krwi i ponownie wymieszać. Objętość roztworu doprowadza się do kreski wodą destylowaną.
Roztwór przesączono do suchej kolby. Odlewa się pierwsze 20-30 ml przesączu, a kolejne porcje wykorzystuje do analizy. Przesącz rozcieńcza się drugi raz tak, aby 100 ml roztworu zawierało węglowodany od 5 do 12 mg. W celu oznaczenia do probówki o pojemności 20 ml zakończonej szlifowanym korkiem wlewa się 10 ml odczynnika antronowego i ostrożnie dodaje 5 ml roztworu badawczego, tak aby ciecze się nie pomieszały, ale powstały dwie warstwy; Probówka zamknięta jest szlifowanym korkiem. Jednocześnie przygotować roztwór ślepej próby dodając 5 ml wody destylowanej do 10 ml odczynnika. Zawartość probówek miesza się energicznie przez 10 sekund i zanurza w szybko wrzącej łaźni wodnej. Wrzenie powinno zostać wznowione w ciągu 0,5 minuty od momentu zanurzenia probówek w kąpieli. Zwróć uwagę na początek wrzenia wody w wannie i poczekaj 5,5 minuty na reakcję. Po przetrzymaniu probówki schładza się w kąpieli z bieżącą wodą do temperatury 20°C. Gęstość optyczną otrzymanego roztworu oznacza się na lewym bębnie fotoelektrokolorymetru przy użyciu dwóch filtrów świetlnych: pomarańczowego o długości fali λ=610 nm i niebiesko-fioletowy o długości fali λ=413 nm w kuwecie o długości boku 5 mm. Kuwetę przepłukuje się 2-3 razy badanym roztworem, a następnie napełnia tak, aby ciecz nie sięgała do krawędzi 5 mm. Zewnętrzne ścianki kuwety przemywa się strumieniem wody i przeciera suchą bibułą filtracyjną. W ten sam sposób przelej ślepą próbę do dwóch innych kuwet tej samej wymiany i określ gęstość optyczną.
Na podstawie wartości gęstości optycznej zawartość rozpuszczalnych węglowodanów niesfermentowanych określa się za pomocą równań:

Gdzie D1 jest gęstością optyczną z filtrem o długości fali A = 610 nm; D2 - gęstość optyczna z filtrem o długości fali A = 413 nm; n jest współczynnikiem rozcieńczenia.
Krótka informacja teoretyczna Metody kolorymetryczne opierają się na wizualnej ocenie absorpcji światła przez roztwory. Analiza kolorymetryczna - mała część analiza spektrofotometryczna. Najprostsze techniki kolorymetryczne pojawiły się w XIX wieku (na przykład metody analizy wody mineralne), ale już dziś w analizach agrochemicznych, hydrochemicznych i klinicznych stosuje się metody ekspresowe, które nie wymagają instrumentów i sprzętu laboratoryjnego. Metody kolorymetryczne stosuje się tam, gdzie szybkość i niski koszt analizy są ważniejsze od jej dokładności. Należy pamiętać, że nowoczesne metody kolorymetryczne wykorzystują te same reakcje fotometryczne, co w instrumentalnych metodach pomiaru absorpcji światła.
Aby oszacować stężenie analitu, możesz użyć różne opcje analiza kolorymetryczna.
1. Metoda skali standardowej. Jest to najczęstsza i najszybsza ze wszystkich metod kolorymetrycznych. Porównuje się w nim widzialną barwę badanego roztworu w identycznych cylindrach lub probówkach z szeregiem barwnych roztworów o tym samym składzie, ale o znanej zawartości substancji oznaczanej w stężeniu X w badanym roztworze, przygotowuje się nowy, bardziej szczegółową skalę specjalnie dla tego zakresu stężeń, a następnie przy jej pomocy wyjaśnij wynik analizy. Metoda skali standardowej nie wymaga prawa Beera (w odróżnieniu od metody wyrównawczej) i daje błąd rzędu 30% wzgl.
Ponieważ oko ludzkie znacznie lepiej rozróżnia odcienie kolorów niż zmiany intensywności tej samej barwy, metoda skali standardowej daje lepsze wyniki w przypadkach, gdy rozwiązania tworzące skalę standardową różnią się kolorem. Na przykład odczynnik organiczny ditizon przy braku metali przejściowych ma czysto zieloną barwę, kompleks ditizonu z cynkiem ma barwę czerwoną, a roztwory standardowej skali zawierające różne ilości cynku i taką samą ilość ditizonu, wzięte w nadmiar, podaj wszystkie możliwe kolory pośrednie między zielonym i czerwonym. W takich przypadkach określenie stężenia metali w standardowej skali nie jest gorsze od wielu metody instrumentalne(błąd około 10%).
2. Miareczkowanie kolorymetryczne. W przypadku tego „miareczkowania” nie zachodzą żadne reakcje chemiczne; nazwa jest dowolna. Metoda polega na przygotowaniu barwnego roztworu z badanej próbki i wlaniu go do określonego naczynia, a do innego podobnego naczynia z czystym rozpuszczalnikiem stopniowo dodaje się wzorcowy barwny roztwór X o znanym stężeniu (większym niż w próbce) aż do uzyskania Rozwiązania kolorystyczne nie są takie same na oko. Ponieważ grubość warstwy absorbującej jest taka sama, uważa się, że po wyrównaniu barw stężenie X w obu roztworach jest również takie samo. Na podstawie objętości zużytego roztworu wzorcowego obliczana jest ilość analitu zawartego w próbce.
3. Metoda rozcieńczania. W tej metodzie przygotowuje się również roztwory barwne testowe i wzorcowe, a następnie ten, który jest intensywniej zabarwiony, rozcieńcza się czystym rozpuszczalnikiem, aż (przy tej samej grubości warstwy roztworu!) ich widoczne kolory zrównają się. Znając stopień rozcieńczenia oblicza się stężenie badanego roztworu.
4. Metoda wyrównywania. Tę samą intensywność absorpcji światła przez roztwory testowe i wzorcowe uzyskuje się tutaj poprzez zmianę grubości warstwy pochłaniającej. Można to zrobić za pomocą specjalnego urządzenia - kolorymetru zanurzeniowego lub po prostu w parze cylindrów, jeśli spojrzysz na nie z góry. Jeśli skład chemiczny obydwa rozwiązania są takie same, prawo Beera jest spełnione, a widzialne kolory (a co za tym idzie gęstości optyczne roztworów) są takie same, możemy napisać:
re st = e l st do st re x = e l x do x do x = do st l st / l x
Metoda wyrównawcza jest dokładniejsza niż inne metody kolorymetryczne i pozwala znaleźć stężenie Cx z błędem 10-20%.
W pracy opisano metody badania wód naturalnych na zawartość różnych substancji toksycznych, przy czym we wszystkich przypadkach zalecana jest metoda skali standardowej. Jednakże, jeśli nauczyciel otrzyma takie polecenie, analizę można przeprowadzić inną metodą wizualną. Rozważmy właściwości niektórych substancji toksycznych, które można oznaczyć w wodach naturalnych metodą kolorymetryczną, a także reakcje powstawania z nich związków barwnych. To właśnie te reakcje będą musiały zostać przeprowadzone podczas prac laboratoryjnych.
Definicja fenoli Fenole to związki aromatyczne z jedną lub większą liczbą grup hydroksylowych bezpośrednio związanych z pierścieniem aromatycznym, takim jak pierścień benzenowy. Wsiadają środowisko ze ścieków z przedsiębiorstw przemysłowych, zwłaszcza z rafinerii koksu i ropy naftowej. Fenole mają silne działanie biologiczne. Kiedy stężenie fenolu w wodzie rzecznej wynosi 0,50 mg/l, ryby giną. W wodzie pitnej na terenie Federacji Rosyjskiej maksymalne dopuszczalne stężenie fenoli wynosi 0,001 mg/l (w przeliczeniu na najprostszy fenol C 6 H 5 OH). Zawartość fenoli w wodzie pitnej, naturalnej i ścieki kontrolowane przez laboratoria służby sanitarnej i inne organizacje. Do oznaczania fenoli używają różne drogi przekształcanie ich w związki barwne; wybór metody analizy zależy od stężenia fenolu w badanej wodzie oraz obecności substancji zakłócających. Czasami w trakcie analizy ilość fenoli oddziela się od nielotnych substancji zakłócających poprzez destylację fenoli z badanej próbki za pomocą pary wodnej; nie jest to wymagane w tej pracy. Jeżeli oczekuje się, że stężenie fenoli będzie wynosić 0,05-50 mg/l (wody silnie zanieczyszczone), wówczas analizę przeprowadza się metodą Griessa stosując reakcję z para-nitroaniliną. Odczynnik ten poddaje się uprzednio (w dniu analizy) diazowaniu azotynem sodu, a następnie przeprowadza się reakcję sprzęgania azowego z fenolem:
2H + ® + 2H 2O
Powstały barwnik azowy ma intensywną żółto-brązową barwę. Stężenie barwnika będzie proporcjonalne do stężenia fenolu w wodzie, jeśli inne odczynniki (azotyn, p-nitroanilina) zostaną pobrane w dużym i równym nadmiarze. Oznaczanie jest nieselektywne: różne fenole dają barwne produkty o podobnych właściwościach. Wydajność produktów zależy w dużym stopniu od pH. Diazowanie prowadzi się w środowisku kwaśnym, a sprzęganie azowe w środowisku zasadowym.
Podczas wykonywania pracy należy pamiętać, że fenole i p-nitroanilina są toksyczne. Ostrożnie!
Oznaczanie azotynów Obecność podwyższonego stężenia azotynów w wodach naturalnych wskazuje na ich zanieczyszczenie ściekami bytowymi. Zawartość azotynów w wodach naturalnych waha się od kilku mikrogramów do dziesiątych części mg na 1 litr (azotyny są mniej toksyczne niż fenole, MPC – 1 mg/l). Do oznaczania azotynów najczęściej stosuje się metodę kolorymetryczną, opartą na reakcji azotynów z kwasem sulfanilowym i a-naftyloaminą (reakcja Griess-Ilosvay). Najpierw obecne azotyny reagują z kwasem sulfanilowym (reakcja diazowania), następnie diazowany kwas sulfanilowy reaguje z a-naftyloaminą (reakcja sprzęgania azowego), w wyniku czego powstaje czerwono-fioletowy barwnik:
Ponieważ oba odczynniki wprowadza się w większym nadmiarze w porównaniu do azotynów, stężenie barwnika i gęstość optyczna jego roztworu zależą wyłącznie od stężenia azotynów. Prawo Beera na ogół jest prawdziwe. Granica wykrywalności azotynów bez dodatkowego stężenia wynosi 1 mg/l. Zakłócają działanie silnych środków utleniających i redukujących.
Oznaczanie chloru Zawartość „aktywnego chloru” oznacza się podczas analizy chlorowanej wody wodociągowej. W niektórych ściekach oznacza się także rozpuszczony chlor, MPC C l = 0,4 mg/l. Oprócz cząsteczek Cl 2 pojęcie „aktywnego chloru” obejmuje także szereg innych niestabilnych związków chloru powstających podczas chlorowania wody, na przykład podchlorynów, chloraminy itp. Wszystkie te związki reagują jak wolny chlor i są oznaczane w całkowity. Wynik analizy wyrażono w przeliczeniu na Cl2 (mg/l). Oznaczenie należy wykonać niezwłocznie po pobraniu próbki wody.
Do oznaczania małych ilości chloru najwygodniejsza jest metoda kolorymetryczna z o-toluidyną. Odczynnik ten ulega utlenieniu pod wpływem chloru (a także innych utleniaczy) według nie do końca poznanego mechanizmu, w wyniku czego roztwór nabiera żółtego lub pomarańczowego zabarwienia. Żelazo (>0,3 mg/l) i azotyny (>0,1 mg/l) zakłócają oznaczenie. W obecności wielu substancji zakłócających oznaczanie chloru staje się poważnie skomplikowane. Odpowiednie techniki opisano w literaturze.
Ponieważ skala wzorcowa zawierająca utlenioną o-toluidynę jest nietrwała podczas przechowywania i niepożądane jest jej codzienne przygotowywanie od nowa, w laboratoriach często stosuje się stabilną, sztuczną skalę przygotowaną z roztworów K 2 CrO 4 i K 2 Cr 2 O 7 . Kolor roztworów wzorcowych w tej skali na oko dokładnie odpowiada barwie roztworów zawierających różne znane ilości produktu reakcji chloru z o-toluidyną. Takie sztuczne łuski są dość często stosowane w praktyce.
Kolorymetria jako metoda analizy chemicznej służy do określenia stężenia określonej substancji w roztworze. Metoda umożliwia pracę z roztworami kolorowymi lub roztworami, które można zabarwić w wyniku określonej reakcji chemicznej.
Podstawy kolorymetrii
Metody analizy chemicznej wykorzystujące kolorymetrię opierają się na prawie Bouguera-Lamberta-Weera, które stwierdza, że intensywność barwy zależy od stężenia substancji barwnej w roztworze oraz od grubości warstwy cieczy.
Stosując różne techniki kolorymetryczne, można z dość dużą dokładnością oszacować zawartość ilościową niektórych substancji w roztworze - zwykle jest to 0,1-1%. Dokładność ta z reguły nie ustępuje dokładności, z jaką wyznaczane są stężenia w wyniku znacznie bardziej skomplikowanych i kosztownych analiz chemicznych i jest wystarczająca do wielu zadań - nie tylko przemysłowych, ale także o charakterze eksperckim. Metodami kolorymetrycznymi można oznaczyć stężenia substancji do 10−8 mol/l.
Metody kolorymetryczne wykorzystują porównanie wizualne lub porównanie za pomocą przyrządów - fotokolorymetrów lub spektrofotometrów. Porównania dokonuje się metodami bezpośrednimi lub kompensacyjnymi.
Metoda bezpośrednia
 Metoda bezpośrednia polega na porównaniu stopnia zabarwienia roztworu badawczego w określonej temperaturze i w określonej warstwie cieczy z roztworem referencyjnym. Wzorzec zawiera dokładnie znaną ilość substancji barwiącej w tej samej temperaturze i w tej samej warstwie cieczy.
Metoda bezpośrednia polega na porównaniu stopnia zabarwienia roztworu badawczego w określonej temperaturze i w określonej warstwie cieczy z roztworem referencyjnym. Wzorzec zawiera dokładnie znaną ilość substancji barwiącej w tej samej temperaturze i w tej samej warstwie cieczy.
Czasami dokonuje się porównań z wodą destylowaną. Z reguły metody takie opierają się na wykorzystaniu fotokolorymetrów lub spektrofotometrów. Przyrządy te mierzą prąd, który zależy od natężenia emitowanego światła przechodzącego przez badany roztwór.
Dokładność pomiaru sprzętowego jest wyższa niż pomiaru wizualnego. Metodę wizualną stosuje się także do porównania intensywności barwy roztworu z roztworami wzorcowymi, w których znane jest stężenie substancji.
Metoda kompensacji
Metoda kompensacji polega na doprowadzeniu barwy próbki testowej do barwy odniesienia. Rozwiązania wykorzystujące różne urządzenia optyczne - zwierciadła, szkła i pryzmaty, umieszczane są w urządzeniu w taki sposób, że łączą się w polu widzenia badacza. Oko jest w stanie dokładnie zarejestrować ten sam kolor dwóch próbek. W niektórych urządzeniach zadanie to ułatwia fakt, że gdy intensywność kolorów się zgadza, zanika wizualna granica, która początkowo oddzielała rozwiązania.
W celu doprowadzenia badanego roztworu do wzorca dodaje się do niego przezroczysty rozpuszczalnik lub zwiększa się wysokość warstwy cieczy. Następnie na podstawie wartości dodanego rozcieńczalnika lub wysokości warstwy roztworu wnioskują cechy ilościowe stężenie barwników w roztworze. Metody kompensacji stosowane są w kolorymetrach wizualnych i fotokolorymetrach. Są najbardziej praktyczne, ponieważ nie mają na nie wpływu czynniki zewnętrzne - na przykład temperatura.
Kiedy i gdzie stosuje się metody kolorymetryczne?
Metody kolorymetryczne analizy chemicznej stosuje się w przypadkach, gdy skład chemiczny roztworu jest dokładnie znany; rozwiązanie jest przejrzyste; istnieje próbka referencyjna; temperatury próbki i roztworu testowego są równe. Za pomocą tych metod można określić stężenia substancji w roztworach bezbarwnych, jeśli możliwe jest zabarwienie roztworu przez dodanie określonego odczynnika.
Stosowana jest kolorymetria:
W chemii analitycznej;
- w medycynie (zawartość krwi);
- do kontroli jakości woda pitna i ścieki;
- w przemyśle spożywczym do oznaczania stopnia oczyszczenia wina, piwa, cukru;
- w przemyśle - do analizy składu olejów smarowych, nafty.
Zalety metod kolorymetrycznych:
Prostota;
- brak konieczności stosowania drogiego sprzętu;
- efektywność pomiarów, możliwość prowadzenia analiz bezpośrednio na produkcji;
- umiejętność oznaczania bardzo małych stężeń substancji trudnych do obliczenia innymi metodami analizy chemicznej.
W sklepie ze szkłem laboratoryjnym sprzęt chemiczny„Prime Chemicals Group” możesz przystępne ceny Kup probówki kolorymetryczne różnej wielkości. Dostarczamy na terenie całej Moskwy i regionu moskiewskiego.
- W kontakcie z 0
- Google+ 0
- OK 0
- Facebook 0