Izotermy eksperymentalne i teoretyczne
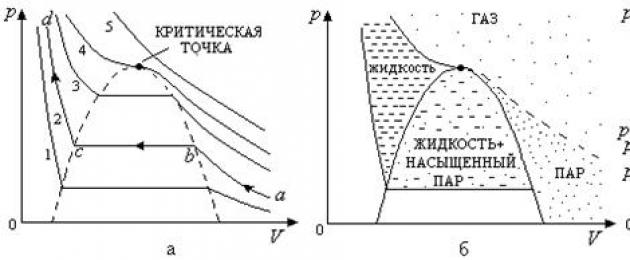
Po raz pierwszy Andrews zbadał eksperymentalne izotermy dla gazów rzeczywistych ( dwutlenek węgla), uzyskano je poprzez powolne izotermiczne sprężanie pary nienasyconej znajdującej się w cylindrze pod tłokiem (izotermy pokazano na ryc. 2.19, a).
Jak widać z izoterm pokazanych na rys. 2.19a, wszystkie zawierają przekrój poziomy, który zmniejsza się wraz ze wzrostem temperatury i po osiągnięciu krytyczna temperatura () znika całkowicie. Temperatura krytyczna odpowiada izotermie krytycznej 4, w punkcie krytycznym występuje punkt przegięcia.
Jeśli zostanie przeprowadzony skrajne punkty poziome odcinki linii izoterm (będzie miała kształt dzwonu), wówczas cały obszar diagramu we współrzędnych (,) zostanie podzielony na trzy obszary (ryc. 2.19,b) - obszar stanów ciekłych , obszar stanów gazowych i obszar stanów dwufazowych (istnieją w nim jednocześnie gazy i ciekły stan materii). Zauważ, że na ryc. 2.19b nie odzwierciedla stanu stałego substancji.
Obszar stanów gazowych, który znajduje się powyżej izotermy krytycznej, nazywany jest gazem. Izotermy w tym obszarze przypominają izotermy gazu doskonałego (rys. 2.19a, izoterma 5). W tym zakresie temperatur substancja występuje tylko w stanie gazowym przy dowolnym ciśnieniu i objętości, tj. Podczas izotermicznego sprężania gazu nie można go zamienić w ciecz w takich temperaturach. Wyjaśnia to fakt, że przez długi czas nie było możliwości przekształcenia helu i wodoru w stan ciekły za pomocą procesu sprężania izotermicznego (dla helu i wodoru temperatury krytyczne wynosiły odpowiednio i). Jeśli weźmiesz gaz poniżej krytycznej izotermy, wówczas przy kompresji izotermicznej można go przekształcić w ciecz. Dlatego też, biorąc pod uwagę ten fakt, w tym obszarze gaz nazywany jest parą nienasyconą.

Przyjrzyjmy się bliżej izotermie nr 2 na ryc. 2.19, o. Można go podzielić na trzy sekcje.
Działka -. Kiedy para nienasycona jest sprężana, przechodzi w stan nasycony.
Działka -. Kondensacja pary nasyconej zachodzi pod stałym ciśnieniem równym ciśnieniu pary nasyconej w danej temperaturze. W tym obszarze objętości dwie fazy substancji - ciekła i para - są w równowadze. Po osiągnięciu tego punktu cała para zamienia się w ciecz.
Działka -. Tutaj obserwuje się stan ciekły substancji. Zmiana objętości cieczy wraz ze wzrostem jej ciśnienia będzie nieznaczna. Dlatego izotermy w tym obszarze są prawie pionowe.
Przyjrzyjmy się bliżej temu, co dzieje się w punkt krytyczny(odpowiadające mu parametry są oznaczone jako , i ).
W punkt krytyczny zauważony krytyczny stan materii, dla niego zanika różnica między cieczą a parą nasyconą. Przejawia się to w tym, że gdy jakaś ciecz zostanie podgrzana w zamkniętym naczyniu i po osiągnięciu temperatury krytycznej, granica między cieczą a parą zaniknie - utworzą jedną jednorodną substancję (gęstości pary i cieczy będą się pokrywać, napięcie powierzchniowe siły zanikną, ciepło parowania wyniesie zero).
3. Porównanie izoterm teoretycznych i doświadczalnych. Rozważmy rodzaj obliczonych izoterm, które można otrzymać z równania (2.86). W tym celu przepisujemy to równanie w następującej postaci:
![]() . (2.88)
. (2.88)
Wiadomo, że takie równanie sześcienne ma jeden lub trzy pierwiastki rzeczywiste. Na ryc. 2.19c przedstawia wykres jednej z obliczonych izoterm - dla niej w obszarze ciśnienia () rozwiązanie równania (2.88) daje trzy pierwiastki rzeczywiste (linia pozioma przecina izotermę w trzech punktach odpowiadających wartościom objętości, I ). Prowadzi to do zygzakowatego (falowego) zachowania izotermy w obszarze jednoczesnego istnienia pary nasyconej i cieczy.

To zachowanie izotermy w tym obszarze nie jest zgodne z eksperymentem. W innych obszarach, gdzie istnieje tylko ciecz lub tylko para, obserwuje się w miarę zadowalającą zgodność pomiędzy eksperymentem a teorią.
Należy zauważyć, że faliste przekroje obliczonych izoterm są częściowo potwierdzone eksperymentalnie. Jeśli stworzysz warunki, w których w gazie nie będzie ośrodków kondensacji (na przykład cząstek pyłu lub jonów), to poprzez powolną kompresję izotermiczną (przejście 1-2-3) możesz uzyskać tzw. para przesycona, odpowiada stanom na izotermie znajdującej się pomiędzy punktami 2 i 3 (rys. 2.20a). W tej temperaturze prężność pary przesyconej przekracza prężność pary nasyconej. Stany te będą metastabilne (niestabilne) - gdy pojawią się centra kondensacji, para przesycona szybko zamienia się w ciecz (przejście 3-4), powstaje stan równowagi pomiędzy parą nasyconą a cieczą.
Stany metastabilne można otrzymać w podobny sposób przegrzana ciecz. Aby to zrobić, konieczne jest usunięcie ośrodków parowania (na przykład cząstek pyłu, pęcherzyków gazów rozpuszczonych w cieczy) z cieczy i ścian naczynia, w którym się ona znajduje. Ciecz przegrzana odpowiada stanom znajdującym się na izotermie pomiędzy punktami 6 i 7 (rys. 2.20a), jej temperatura będzie wyższa od temperatury wrzenia. Jeśli w cieczy pojawią się centra parowania, natychmiast wrze (przejście 7-8).
Stany odpowiadające części izotermy pomiędzy punktami 3 i 7 (oznaczone linią przerywaną) są całkowicie niestabilne (rys. 2.20a) i nie są realizowane w praktyce.
Na przykład na ryc. Rysunek 2.20b przedstawia wykresy obliczonych izoterm w różnych temperaturach. Konstruując je, należy wziąć pod uwagę, że obszary figur i muszą być takie same (ryc. 2.20, c), jest to konsekwencja drugiej zasady termodynamiki.
4. Parametry krytyczne substancji. Zastanówmy się, jak wykorzystując wyznaczone eksperymentalnie parametry krytyczne substancji (), odpowiadające punktowi krytycznemu, możemy oszacować stałe i ujęte w równaniu van der Waalsa.
Punkt krytyczny izotermy krytycznej odpowiada punktowi przegięcia i w tym momencie styczna do wykresu będzie pozioma. Oznacza to, że w tym momencie pierwsza i druga pochodna objętościowego ciśnienia gazu są równe zeru. Znajdźmy te pochodne. W tym celu przepisujemy równanie (12.99) w następującej postaci:
![]()
![]() ,
, ![]() .
.
Zwykle nazywa się stan pośredni substancji pomiędzy stanem gazu rzeczywistego a stanem cieczy parujący lub po prostu prom. Przemiana cieczy w parę jest przejście fazowe z jednego stanu skupienia do drugiego. Podczas przejścia fazowego obserwuje się nagłą zmianę właściwości fizycznych substancji.
Przykładami takich przejść fazowych jest proces wrzenie płynny z wyglądu mokra para nasycona i późniejsze przejście w stan pozbawiony wilgoci sucha para nasycona lub odwrotny proces wrzenia kondensacja para nasycona.
Jedną z głównych właściwości suchej pary nasyconej jest to, że dalsze dostarczanie do niej ciepła prowadzi do wzrostu temperatury pary, tj. jej przejścia do stanu pary przegrzanej, a odprowadzanie ciepła prowadzi do przejścia do stanu mokrego para nasycona. W
Stany fazowe wody
Rysunek 1. Diagram fazowy pary wodnej we współrzędnych T, s.
RegionI– stan gazowy (para przegrzana o właściwościach gazu rzeczywistego);
RegionII– stan równowagi wody i pary wodnej nasyconej (stan dwufazowy). Region II nazywany jest także obszarem parowania;
RegionIII– stan ciekły (woda). Region III jest ograniczony izotermą EK;
RegionIV– stan równowagi fazy stałej i ciekłej;
RegionV- stan stały;
Regiony III, II i I są wyodrębnione linie graniczne AK (lewa linia) i KD (prawa linia). Punkt wspólny K dla linii granicznych AK i KD ma specjalne właściwości i nazywa się go punkt krytyczny. Ten punkt ma parametry Pkr, wkr I T kr, w którym wrząca woda zamienia się w przegrzaną parę, omijając obszar dwufazowy. W rezultacie woda nie może istnieć w temperaturach powyżej Tcr.
Punkt krytyczny K ma następujące parametry:
Pkr= 22,136 MPa; wkr= 0,00326 m 3 /kg; Tkr= 374,15°C.
Wartości p, t, w I S dla obu linii granicznych podano w specjalnych tablicach właściwości termodynamicznych pary wodnej.
Proces otrzymywania pary wodnej z wody
Na rysunkach 2 i 3 przedstawiono procesy podgrzewania wody do wrzenia, tworzenia się pary oraz przegrzania pary wodnej p, w- I T., s-schematy.
Początkowy stan ciekłej wody pod ciśnieniem P 0 i mający temperaturę 0°C, przedstawiono na wykresach p, w I T., s kropka A. Kiedy ciepło jest dostarczane o godz P= const wzrasta jego temperatura i wzrasta objętość właściwa. W pewnym momencie temperatura wody osiąga punkt wrzenia. W tym przypadku jego stan jest oznaczony kropką B. Przy dalszym dostarczaniu ciepła parowanie rozpoczyna się od silnego wzrostu objętości. W tym przypadku powstaje ośrodek dwufazowy – mieszanina wody i pary, tzw mokra para nasycona. Temperatura mieszaniny nie zmienia się, ponieważ ciepło jest zużywane na odparowanie fazy ciekłej. Proces odparowania na tym etapie jest izobaryczno-izotermiczny i jest oznaczony na schemacie jako przekrój pne. Następnie w pewnym momencie cała woda zamienia się w parę, tzw suche nasycone. Stan ten jest oznaczony na schemacie kropką C.

Rysunek 2. Wykres P, v dla wody i pary wodnej.

Rysunek 3. Wykres T, s dla wody i pary wodnej.
Przy dalszym dostarczaniu ciepła temperatura pary wzrośnie i nastąpi proces przegrzania pary płyta CD. Kropka D wskazuje stan pary przegrzanej. Odległość punktowa D z punktu Z zależy od temperatury pary przegrzanej.
Indeksacja w celu wskazania ilości powiązanych różne warunki woda i para:
- wartość o indeksie „0” odnosi się do stanu początkowego wody;
- wartość z indeksem „′” dotyczy wody podgrzanej do temperatury wrzenia (nasycenia);
- wartość z indeksem „″” odnosi się do pary nasyconej suchej;
- ilość z indeksem " X» odnosi się do mokrej pary nasyconej;
- wartość bez indeksu dotyczy pary przegrzanej.
Proces odparowania pod wyższym ciśnieniem p 1 > p 0 można zauważyć, że punkt A, przedstawiający początkowy stan wody w temperaturze 0 ° C i nowe ciśnienie, pozostaje praktycznie na tym samym pionie, ponieważ objętość właściwa wody jest prawie niezależna od ciśnienia.
Kropka B'(stan wody w temperaturze nasycenia) przesuwa się w prawo o p, w-schemat i wzrasta do T., s-diagram. Dzieje się tak dlatego, że wraz ze wzrostem ciśnienia wzrasta temperatura nasycenia, a co za tym idzie, objętość właściwa wody.
Kropka C'(stan suchej pary nasyconej) przesuwa się w lewo, ponieważ wraz ze wzrostem ciśnienia objętość właściwa pary maleje, pomimo wzrostu temperatury.
Łączenie wielu kropek B I C przy różnych ciśnieniach daje dolną i górną krzywą graniczną ok I kc. Z p, w- z wykresu wynika, że wraz ze wzrostem ciśnienia różnica poszczególnych objętości v″ I v′ maleje i przy pewnym ciśnieniu staje się równe zeru. W tym punkcie, zwanym krytycznym, krzywe graniczne zbiegają się ok I kc. Stan odpowiadający punktowi k, zwany krytyczny. Charakteryzuje się tym, że w nim para i woda mają te same objętości właściwe i nie różnią się od siebie właściwościami. Region leżący w trójkącie krzywoliniowym bkc(W p, w-schemat), odpowiada wilgotnej parze nasyconej.
Stan pary przegrzanej reprezentują punkty leżące powyżej górnej krzywej granicznej kc.
NA T., s-obszar diagramu 0 mięśnie brzucha odpowiada ilości ciepła potrzebnej do ogrzania wody w stanie ciekłym do temperatury nasycenia.
Ilość dostarczonego ciepła, J/kg, równa ciepłu parowania R, wyrażona powierzchnią s′bcs, i dla niego zachodzi następująca zależność:
R = T(SS').
Ilość ciepła dostarczonego w procesie przegrzania pary wodnej jest reprezentowana przez powierzchnię s″cd.
NA T., s Z wykresu wynika, że wraz ze wzrostem ciśnienia ciepło parowania maleje i w punkcie krytycznym osiąga wartość zero.
Zazwyczaj T., s-diagram jest wykorzystywany w badaniach teoretycznych, gdyż jego praktyczne zastosowanie znacznie utrudnia fakt, że ilości ciepła wyrażane są poprzez pola figur krzywoliniowych.
Na podstawie materiałów z moich notatek z wykładów z termodynamiki oraz podręcznika „Podstawy Energii”. Autor G. F. Bystritsky. Wydanie 2, wyd. i dodatkowe - M.: KNORUS, 2011. - 352 s.
Ściśle mówiąc, w tym materiale krótko rozważymy nie tylko chemiczne i właściwości fizyczne woda w stanie ciekłym, ale także właściwości mu właściwe jako takie.
Więcej o właściwościach wody w stanie stałym można przeczytać w artykule - WŁAŚCIWOŚCI WODY W STANIE STAŁYM (czytaj →).
Woda jest niezwykle ważną substancją dla naszej planety. Bez niego życie na Ziemi jest niemożliwe; bez niego nie zachodzi żaden proces geologiczny. Wielki naukowiec i myśliciel Władimir Iwanowicz Wiernadski napisał w swoich pracach, że nie ma takiego elementu, którego znaczenie można „porównać z nim pod względem wpływu na przebieg głównych, najpotężniejszych procesów geologicznych”. Woda jest obecna nie tylko w organizmie wszystkich istot żywych na naszej planecie, ale także we wszystkich substancjach na Ziemi – w minerałach, w skałach… Badanie unikalnych właściwości wody odkrywa przed nami coraz to nowe tajemnice, zadaje nam nowe zagadki i stawia nowe wyzwania.
Anomalne właściwości wody
Wiele właściwości fizyczne i chemiczne wody zaskoczyć i wypaść Główne zasady i wzorce oraz są nietypowe, na przykład:
- Zgodnie z prawami ustanowionymi przez zasadę podobieństwa, w ramach nauk takich jak chemia i fizyka, moglibyśmy oczekiwać, że:
- woda będzie wrzeć w temperaturze minus 70°C i zamarzać w temperaturze minus 90°C;
- woda nie będzie kapać z końcówki kranu, ale będzie płynąć cienkim strumieniem;
- lód będzie raczej opadał, niż unosił się na powierzchni;
- więcej niż kilka ziarenek cukru nie rozpuściłoby się w szklance wody.
- Powierzchnia wody ma ujemny potencjał elektryczny;
- Po podgrzaniu od 0°C do 4°C (dokładnie 3,98°C) woda kurczy się;
- Zaskakująca jest wysoka pojemność cieplna wody w stanie ciekłym;
Jak wspomniano powyżej, w tym materiale wymienimy główne właściwości fizyczne i chemiczne wody oraz poczynimy krótkie komentarze na temat niektórych z nich.
Właściwości fizyczne wody
WŁAŚCIWOŚCI FIZYCZNE to właściwości, które pojawiają się poza reakcjami chemicznymi.
Czystość wody
Czystość wody zależy od obecności w niej zanieczyszczeń, bakterii, soli metali ciężkich..., aby zapoznać się z interpretacją terminu CZYSTA WODA według naszej strony internetowej, należy zapoznać się z artykułem CZYSTA WODA (czytaj → ).
Kolor wody
Kolor wody zależy od skład chemiczny i zanieczyszczenia mechaniczne
Jako przykład podamy definicję „Koloru morza” podaną przez Wielką Encyklopedię Radziecką.
Kolor morza. Kolor postrzegany przez oko obserwatora patrzącego na powierzchnię morza. Kolor morza zależy od koloru wody morskiej, koloru nieba, liczby i charakteru chmur, wysokości Słońca nad poziomem morza. horyzont i inne powody.
Pojęcie koloru morza należy odróżnić od pojęcia koloru wody morskiej. Kolor wody morskiej odnosi się do koloru postrzeganego przez oko patrzące na wodę morską pionowo na białym tle. Tylko niewielka część padających na nią promieni świetlnych odbija się od powierzchni morza, reszta wnika w głębiny, gdzie są pochłaniane i rozpraszane przez cząsteczki wody, cząstki zawieszonych substancji i maleńkie pęcherzyki gazu. Rozproszone promienie odbite i wyłaniające się z morza tworzą widmo kolorów Cząsteczki wody najbardziej rozpraszają promienie niebieskie i zielone. Zawieszone cząstki rozpraszają wszystkie promienie prawie równomiernie. Dlatego woda morska z niewielką ilością zawiesin ma barwę niebieskozieloną (kolor otwartych części oceanów), a przy znacznej ilości zawiesiny ma barwę żółtawo-zieloną (np. Morze Bałtyckie). Teoretyczną stronę doktryny matematyki centralnej opracowali V. V. Shuleikin i C. V. Raman.
Wielka encyklopedia radziecka. - M .: Encyklopedia radziecka. 1969-1978
Zapach wody
Zapach wody - czysta woda Z reguły jest bezwonny.
Przejrzystość wody
Przezroczystość wody zależy od rozpuszczonych w niej minerałów oraz zawartości zanieczyszczeń mechanicznych, materia organiczna i koloidy:
PRZEJRZYSTOŚĆ WODY to zdolność wody do przepuszczania światła. Zwykle mierzony za pomocą dysku Secchiego. Zależy głównie od stężenia zawieszonych i rozpuszczonych substancji organicznych oraz substancje nieorganiczne. Może gwałtownie spaść w wyniku antropogenicznego zanieczyszczenia i eutrofizacji zbiorników wodnych.
Ekologiczny słownik encyklopedyczny. - Kiszyniów I.I. Dedu. 1989
PRZEJRZYSTOŚĆ WODY to zdolność wody do przepuszczania promieni świetlnych. Zależy to od grubości warstwy wody, przez którą przechodzą promienie, obecności zanieczyszczeń zawieszonych, substancji rozpuszczonych itp. W wodzie promienie czerwone i żółte są silniej absorbowane, a promienie fioletowe wnikają głębiej. Ze względu na stopień przezroczystości, w celu jego zmniejszenia, wyróżnia się wody:
- przezroczysty;
- lekko opalizujący;
- opalizujący;
- lekko pochmurno;
- pochmurny;
- bardzo pochmurno.
Słownik hydrogeologii i geologii inżynierskiej. - M.: Gostoptekhizdat. 1961
Smak wody
Smak wody zależy od składu substancji w niej rozpuszczonych.
Słownik hydrogeologii i geologii inżynierskiej
Smak wody to właściwość wody zależna od rozpuszczonych w niej soli i gazów. Istnieją tabele smakowitych stężeń soli rozpuszczonych w wodzie (w mg/l), np. poniższa tabela (wg. Staffa).
Temperatura wody
Temperatura topnienia wody:
TEMPERATURA TOPNIENIA – temperatura, w której substancja zmienia się ze stanu stałego w ciecz. Temperatura topnienia ciała stałego jest równa temperaturze zamarzania cieczy, na przykład temperatura topnienia lodu, O°C, jest równa temperaturze zamarzania wody.
Temperatura wrzenia wody : 99,974°C
Naukowy i techniczny słownik encyklopedyczny
TEMPERATURA WRZENIA, temperatura, w której substancja przechodzi z jednego stanu (fazy) do drugiego, to znaczy z cieczy do pary lub gazu. Temperatura wrzenia wzrasta wraz ze wzrostem ciśnienia zewnętrznego i maleje wraz ze spadkiem ciśnienia. Zwykle mierzy się go przy ciśnieniu standardowym 1 atmosfery (760 mm Hg). Temperatura wrzenia wody pod ciśnieniem normalnym wynosi 100°C.
Naukowy i techniczny słownik encyklopedyczny.
Potrójny punkt wody
Punkt potrójny wody: 0,01 ° C, 611,73 Pa;
Naukowy i techniczny słownik encyklopedyczny
PUNKT POTRÓJNY, temperatura i ciśnienie, w którym wszystkie trzy stany skupienia (stały, ciekły, gazowy) mogą jednocześnie istnieć. W przypadku wody punkt potrójny znajduje się w temperaturze 273,16 K i ciśnieniu 610 Pa.
Naukowy i techniczny słownik encyklopedyczny.
Napięcie powierzchniowe wody
Napięcie powierzchniowe wody - określa siłę przylegania cząsteczek wody do siebie, na przykład od tego parametru zależy, w jaki sposób ta lub inna woda jest wchłaniana przez organizm ludzki.
Twardość wody
Słownik morski
TWARDOŚĆ WODY (sztywność wody) – właściwość wody wykrwawionej pod wpływem zawartości rozpuszczonych w niej soli metali ziem alkalicznych, rozdz. przyr. wapnia i magnezu (w postaci soli wodorowęglanowych – wodorowęglanów) oraz soli mocnych kwasów mineralnych – siarkowego i solnego. LV mierzy się w specjalnych jednostkach, tzw. stopnie twardości. Stopień twardości to wagowa zawartość tlenku wapnia (CaO), równa 0,01 g w 1 litrze wody. Twarda woda nie nadaje się do zasilania kotłów, gdyż sprzyja silnemu osadzaniu się kamienia na ich ściankach, co może skutkować przepaleniem rur kotłów. Kotły o dużej wydajności, a zwłaszcza wysokie ciśnienia należy zasilać całkowicie oczyszczoną wodą (kondensacją z silniki parowe i turbin, oczyszczone na filtrach z zanieczyszczeń olejowych, a także destylat przygotowany w specjalnej aparacie wyparnym).
Słownik morski Samoilova K.I. — M.-L.: Państwowe Wydawnictwo Marynarki Wojennej NKWMF ZSRR, 1941
Naukowy i techniczny słownik encyklopedyczny
TWARDOŚĆ WODY, niezdolność wody do tworzenia piany z mydłem z powodu rozpuszczonych w niej soli, głównie wapnia i magnezu.
Kamień w kotłach i rurach powstaje na skutek obecności w wodzie rozpuszczonego węglanu wapnia, który przedostaje się do wody w kontakcie z wapieniem. W gorącej lub wrzącej wodzie węglan wapnia wytrąca się w postaci twardych osadów wapiennych na powierzchniach wewnątrz kotłów. Węglan wapnia zapobiega również pienieniu się mydła. Pojemnik jonowymienny (3) jest wypełniony granulkami pokrytymi materiałami zawierającymi sód. z którymi styka się woda. Jony sodu, jako bardziej aktywne, zastępują jony wapnia. Ponieważ sole sodu pozostają rozpuszczalne nawet po ugotowaniu, kamień nie tworzy się.
Naukowy i techniczny słownik encyklopedyczny.
Struktura wody
Mineralizacja wody
Mineralizacja wody :
Ekologiczny słownik encyklopedyczny
MINERALIZACJA WODY - nasycanie wody substancjami nieorganicznymi. występujące w nim substancje (mineralne) w postaci jonów i koloidów; całkowita ilość soli nieorganicznych zawartych głównie w wodzie słodkiej, stopień mineralizacji wyraża się zwykle w mg/l lub g/l (czasami w g/kg).
Ekologiczny słownik encyklopedyczny. - Kiszyniów: Główna redakcja pisma mołdawskiego Encyklopedia radziecka. I.I. Dedu. 1989
Lepkość wody
Lepkość wody charakteryzuje wewnętrzny opór cząstek cieczy na jej ruch:
Słownik geologiczny
Lepkość wody (cieczy) to właściwość cieczy powodująca występowanie siły tarcia podczas ruchu. Jest to czynnik przenoszący ruch z warstw wody poruszających się z dużą prędkością na warstwy z mniejszą prędkością. V. w. zależy od temperatury i stężenia roztworu. Fizycznie jest to szacowane za pomocą współczynnika. lepkość, która jest zawarta w wielu wzorach ruchu wody.
Słownik geologiczny: w 2 tomach. - M.: Nedra. Pod redakcją K. N. Paffengoltza i in. 1978
Istnieją dwa rodzaje lepkości wody:
- Lepkość dynamiczna wody wynosi 0,00101 Pa·s (w temperaturze 20°C).
- Lepkość kinematyczna wody wynosi 0,01012 cm 2 /s (w temperaturze 20°C).
Punkt krytyczny wody
Punktem krytycznym wody jest jej stan przy określonym stosunku ciśnienia i temperatury, gdy jej właściwości są takie same w stanie gazowym i ciekłym (faza gazowa i ciekła).
Punkt krytyczny wody: 374°C, 22,064 MPa.
Stała dielektryczna wody
Ogólnie rzecz biorąc, stała dielektryczna jest współczynnikiem pokazującym, o ile siła oddziaływania między dwoma ładunkami w próżni jest większa niż w określonym środowisku.
W przypadku wody liczba ta jest niezwykle wysoka, a dla statycznych pól elektrycznych wynosi 81.
Pojemność cieplna wody
Pojemność cieplna wody - woda ma zaskakująco dużą pojemność cieplną:
Słownik ekologiczny
Pojemność cieplna to właściwość substancji polegająca na pochłanianiu ciepła. Wyraża się ją jako ilość ciepła pochłoniętą przez substancję podczas jej ogrzewania o 1°C. Pojemność cieplna wody wynosi około 1 cal/g, czyli 4,2 J/g. Pojemność cieplna gleby (w temperaturze 14,5-15,5°C) waha się (od gleb piaszczystych do torfowych) od 0,5 do 0,6 cal (lub 2,1-2,5 J) na jednostkę objętości i od 0,2 do 0,5 cal (lub 0,8-2,1 J ) na jednostkę masy (g).
Słownik ekologiczny. - Alma-Ata: „Nauka”. licencjat Bykow. 1983
Naukowy i techniczny słownik encyklopedyczny
CIEPŁO WŁAŚCIWE (symbol c), ciepło potrzebne do ogrzania 1 kg substancji o 1 K. Mierzy się ją w J/K.kg (gdzie J to JOUL). Wymagają tego substancje o dużej pojemności cieplnej właściwej, takie jak woda więcej energii do podniesienia temperatury niż substancje o niskim cieple właściwym.
Naukowy i techniczny słownik encyklopedyczny.
Przewodność cieplna wody
Przewodność cieplna substancji oznacza jej zdolność do przewodzenia ciepła z cieplejszych części do zimniejszych części.
Przenikanie ciepła w wodzie zachodzi albo na poziomie molekularnym, tj. przenoszone przez cząsteczki wody, albo w wyniku ruchu / przemieszczania dowolnych objętości wody - turbulentne przewodnictwo cieplne.
Przewodność cieplna wody zależy od temperatury i ciśnienia.
Płynność wody
Przez płynność substancji rozumie się ich zdolność do zmiany kształtu pod wpływem Napięcie stałe lub stałe ciśnienie.
O płynności cieczy decyduje także ruchliwość ich cząstek, które w stanie spoczynku nie są w stanie odbierać naprężeń ścinających.
Indukcyjność wody
Indukcyjność określa właściwości magnetyczne zamkniętych obwodów prądu elektrycznego. Woda, z wyjątkiem niektórych przypadków, przewodzi prąd elektryczny i dlatego ma pewną indukcyjność.
Gęstość wody
Gęstość wody określa się jako stosunek jej masy do objętości w określonej temperaturze. Przeczytaj więcej w naszym materiale - CO TO JEST GĘSTOŚĆ WODY(czytaj →).
Ściśliwość wody
Ściśliwość wody jest niewielka i zależy od zasolenia wody i ciśnienia. Na przykład dla wody destylowanej jest to 0,0000490.
Przewodność elektryczna wody
Przewodność elektryczna wody w dużej mierze zależy od ilości rozpuszczonych w niej soli.
Radioaktywność wody
Radioaktywność wody zależy od zawartości w niej radonu, emisji radu.
Właściwości fizykochemiczne wody
Słownik hydrogeologii i geologii inżynierskiej
WŁAŚCIWOŚCI FIZYKOCHEMICZNE WODY - parametry określające właściwości fizykochemiczne wody naturalne. Należą do nich wskaźniki stężenia jonów wodorowych (pH) i potencjału oksydacyjno-redukcyjnego (Eh).
Słownik hydrogeologii i geologii inżynierskiej. - M.: Gostoptekhizdat. Opracowane przez A. A. Makkaveeva, redaktor O. K. Lange. 1961
Bilans kwasowo-zasadowy wody
Potencjał redoks wody
Potencjał oksydacyjno-redukcyjny wody (ORP) to zdolność wody do wchodzenia w reakcje biochemiczne.
Właściwości chemiczne wody
WŁAŚCIWOŚCI CHEMICZNE SUBSTANCJI to właściwości powstałe w wyniku reakcji chemicznych.
Poniżej są Właściwości chemiczne woda według podręcznika „Podstawy chemii. Podręcznik internetowy” A. V. Manuilovej, V. I. Rodionowa.
Oddziaływanie wody z metalami
Kiedy woda wchodzi w interakcję z większością metali, zachodzi reakcja, w wyniku której uwalnia się wodór:
- 2Na + 2H2O = H2 + 2NaOH (hałaśliwy);
- 2K + 2H2O = H2 + 2KOH (hałaśliwy);
- 3Fe + 4H2O = 4H2 + Fe3O4 (tylko po podgrzaniu).
Nie wszystkie, ale tylko metale dostatecznie aktywne, mogą brać udział w reakcjach redoks tego typu. Najłatwiej reagują metale alkaliczne i metale ziem alkalicznych z grup I i II.
Oddziaływanie wody z niemetalami
Z niemetali na przykład węgiel i jego związek wodorowy (metan) reagują z wodą. Substancje te są znacznie mniej aktywne niż metale, ale nadal mogą reagować z wodą w wysokich temperaturach:
- C + H2O = H2 + CO (wysoka temperatura);
- CH4 + 2H2O = 4H2 + CO2 (przy wysokiej temperaturze).
Oddziaływanie wody z prądem elektrycznym
Pod wpływem prądu elektrycznego woda rozkłada się na wodór i tlen. Jest to również reakcja redoks, w której woda jest zarówno środkiem utleniającym, jak i reduktorem.
Oddziaływanie wody z tlenkami niemetali
Woda reaguje z wieloma tlenkami niemetali i niektórymi tlenkami metali. To nie są reakcje redoks, ale reakcje sprzęgania:
SO2 + H2O = H2SO3 (kwas siarkawy)
SO3 + H2O = H2SO4 (kwas siarkowy)
CO2 + H2O = H2CO3 (kwas węglowy)
Oddziaływanie wody z tlenkami metali
Niektóre tlenki metali mogą również łączyć się z wodą. Widzieliśmy już przykłady takich reakcji:
CaO + H2O = Ca(OH)2 (wodorotlenek wapnia (wapno gaszone)
Nie wszystkie tlenki metali mogą reagować z wodą. Niektóre z nich są praktycznie nierozpuszczalne w wodzie i dlatego nie reagują z wodą. Np.: ZnO, TiO2, Cr2O3, z których przygotowuje się np. farby wodoodporne. Tlenki żelaza są również nierozpuszczalne w wodzie i nie reagują z nią.
Nawilża i krystalicznie nawilża
Woda tworzy związki, hydraty i hydraty krystaliczne, w których cząsteczka wody jest całkowicie zachowana.
Na przykład:
- CuSO4 + 5 H2O = CuSO4,5H2O;
- CuSO4 jest białą substancją (bezwodny siarczan miedzi);
- CuSO4,5H2O - krystaliczny hydrat (siarczan miedzi), niebieskie kryształy.
Inne przykłady tworzenia hydratów:
- H2SO4 + H2O = H2SO4.H2O (hydrat kwasu siarkowego);
- NaOH + H2O = NaOH.H2O (wodzian sody kaustycznej).
Jako środki osuszające stosuje się związki wiążące wodę w hydraty i hydraty krystaliczne. Za ich pomocą na przykład para wodna jest usuwana z wilgotnego powietrza atmosferycznego.
Biosynteza
Woda bierze udział w biosyntezie, w wyniku której powstaje tlen:
6n CO 2 + 5n H 2 O = (C 6 H 10 O 5) n + 6n O 2 (pod wpływem światła)
 Widzimy, że właściwości wody są różnorodne i obejmują niemal wszystkie aspekty życia na Ziemi. Jak sformułował jeden z naukowców... należy badać wodę kompleksowo, a nie w kontekście jej indywidualnych przejawów.
Widzimy, że właściwości wody są różnorodne i obejmują niemal wszystkie aspekty życia na Ziemi. Jak sformułował jeden z naukowców... należy badać wodę kompleksowo, a nie w kontekście jej indywidualnych przejawów.
Przygotowując materiał wykorzystano informacje z książek - Yu. P. Rassadkin „Zwykła i niezwykła woda”, Yu Ya. Fialkov „Niezwykłe właściwości zwykłych rozwiązań”, Podręcznik „Podstawy chemii. Podręcznik internetowy” A. V. Manuilovej, V. I. Rodionowa i innych.
Ciecz, taka jak woda, może występować w stanie stałym, ciekłym i gazowym, co nazywa się stany fazowe materii. W cieczach odległości między cząsteczkami są w przybliżeniu o dwa rzędy wielkości mniejsze niż w gazach. W ciele stałym cząsteczki znajdują się jeszcze bliżej siebie. Temperatura, w której się zmienia fazowy stan materii(ciecz - ciało stałe, ciecz - gaz), tzw temperatura przejścia fazowego.
Ciepło przemiany fazowej lub ciepło utajone to ilość ciepła topnienia lub parowania substancji. Rysunek 6.9 pokazuje zależność temperatury wody od ilości ciepła otrzymanego w kaloriach. Można zauważyć, że w temperaturach 0 0 C i 100 0 C następuje zmiana stanu fazowego wody, ale temperatura wody nie ulega zmianie. Pochłonięte ciepło jest wykorzystywane do zmiany stanu fazowego substancji. Fizycznie oznacza to, że gdy ciało stałe, np. lód, zostanie ogrzane do temperatury 0 0 C, amplituda drgań cząsteczek względem siebie wzrasta. Prowadzi to do wzrostu ich energii potencjalnej, a w konsekwencji do osłabienia lub zerwania wiązań międzycząsteczkowych. Cząsteczki lub ich skupiska mogą poruszać się względem siebie. Lód zamienia się w ciecz w stałej temperaturze. Po zmianie stanu skupienia ze stałego na ciekły, absorpcja ciepła powoduje wzrost temperatury zgodnie z prawem liniowym. Dzieje się tak do 100 0 C. Wtedy energia wibrujących cząsteczek wzrasta tak bardzo, że cząsteczki są w stanie pokonać przyciąganie innych cząsteczek. Gwałtownie odrywają się nie tylko od powierzchni wody, ale także tworzą pęcherzyki pary w całej objętości cieczy. Pod wpływem siły wyporu wypływają na powierzchnię i są wyrzucane. W tej przemianie fazowej woda zamienia się w parę. Ponadto absorpcja ciepła ponownie prowadzi do wzrostu temperatury pary zgodnie z prawem liniowym.
Ciepło uwolnione lub pochłonięte podczas przejścia fazowego zależy od masy substancji.
Kiedy substancja o masie m przechodzi ze stanu ciekłego do gazowego lub odwrotnie, ze stanu gazowego do ciekłego, ciepło Q jest pochłaniane lub uwalniane:
Ciepło właściwe parowania Q potrzebna do przekształcenia 1 kg cieczy w parę w temperaturze wrzenia:
Kiedy substancja przechodzi ze stanu stałego do ciekłego i z powrotem, pewna ilość ciepła jest pochłaniana lub przekazywana:
Specyficzne ciepło topnienia q nazywa się ilością ciepła Q wymagane do przekształcenia 1 kg ciała stałego (np. lodu) w ciecz w temperaturze topnienia:
Ciepło właściwe topnienie i parowanie mierzy się w J/kg. Wraz ze wzrostem temperatury ciepło właściwe parowania maleje, a w temperaturze krytycznej staje się równe zeru.
W przypadku wody ciepło właściwe topnienia i parowania wynosi odpowiednio:
![]() ,
, ![]() .
.
Stosowana jest tutaj pozasystemowa jednostka miary ilości energii - kaloria, równa ilości ciepła potrzebnej do ogrzania 1 grama wody o 1°C przy normalnym ciśnieniu atmosferycznym wynoszącym 101,325 kPa.
Jak widać na ryc. 6.17, podgrzanie lodu od -20 0 C do 0 0 C wymaga osiem razy mniej energii niż przekształcenie go z lodu w wodę i 54 razy mniej niż zamiana wody w parę.

Ryc.6.17. Zależność temperatury od ciepła dostarczanego do układu
na 1 kg lodu.
Nazywa się temperaturą, w której zanika różnica między parą a cieczą krytyczny. Na ryc. Rysunek 6.18 ilustruje koncepcję temperatury krytycznej na podstawie zależności gęstości wody i pary od temperatury. Gdy woda jest podgrzewana w zamkniętej probówce, jak widać na ryc. 6.18, gęstość wody maleje wraz ze wzrostem temperatury w wyniku objętościowego rozszerzania się wody, a gęstość pary wzrasta. W pewnej temperaturze, zwanej krytyczną, gęstość pary staje się równa gęstości wody.
Każda substancja ma swoją własną temperaturę krytyczną. Dla wody, azotu i helu temperatury krytyczne wynoszą odpowiednio:
, , ![]() .
.

Ryc.6.18. Punkt krytyczny na wykresie zależności
gęstość pary i wody od temperatury.

Ryc.6.19. Zależność ciśnienia od objętości p=p(V) dla pary. W obszarze zaznaczonym linią przerywaną substancja znajduje się w stanie gazowym i ciekłym jednocześnie.
Rysunek 6.19 przedstawia zależność ciśnienia pary od jej objętości P=P(V). Równanie stanu pary przy niskim ciśnieniu i daleko od temperatury jej przejścia fazowego (powyżej punktu b 0 na rys. 6.19) jest zbliżone do równania stanu gazu doskonałego (czyli w tym przypadku gaz może być uważany za idealny, a jego zachowanie dobrze opisuje prawo Boyle’a-Moriotta). W miarę spadku temperatury zależność P=P(V) zaczyna odbiegać od swojej postaci dla gazu doskonałego. Lokalizacja na a – b następuje kondensacja pary, a ciśnienie pary pozostaje prawie niezmienione, a zależność na ryc. 6.19 jest wolno malejącą funkcją liniową. Poniżej punktu A, cała para staje się cieczą, a następnie następuje sprężanie cieczy. W tym przypadku, jak widać na ryc. 6.11, ciśnienie przy bardzo niewielkim spadku objętości, ponieważ ciecz jest praktycznie nieściśliwa, gwałtownie wzrasta.
Ponieważ temperatura przemiany fazowej zależy od ciśnienia gazu, przejścia fazowe można przedstawić wykorzystując zależność ciśnienia od temperatury P=P(T) na rys. 6.20. Na granicy para-ciecz następuje zmiana stanu fazowego substancji, solidny- ciecz, ciało stałe - para. Po różnych stronach tych linii granicznych występuje inny gaz stan skupienia– w postaci stałej, ciekłej lub gazowej.

Ryc.6.20. Diagram fazowy dla wody.
Nazywa się punkt przecięcia trzech linii na ryc. 6.12 potrójny punkt. Na przykład woda o temperaturze 0 0 C i ciśnieniu atm. ma punkt potrójny, a dwutlenek węgla ma punkt potrójny w temperaturze i ciśnieniu P = 5,1 atm. Rysunek 6.20 pokazuje, że możliwe jest przejście substancji ze stanu gazowego do stałego i odwrotnie, z pominięciem stanu ciekłego.
Nazywa się przejście substancji ze stanu stałego do stanu gazowego sublimacja.
Przykład: chłodzenie suchym lodem, np. opakowania lodów na tackach. W tym przypadku, jak widzieliśmy już wiele razy, suchy lód zamienia się w parę.
Jeśli w zamkniętym naczyniu zostanie umieszczona pewna ilość cieczy, wówczas część cieczy odparuje, a nad cieczą utworzy się para nasycona. Ciśnienie, a co za tym idzie i gęstość tej pary, zależy od temperatury. Gęstość pary jest zwykle znacznie mniejsza niż gęstość cieczy w tej samej temperaturze. Jeśli zwiększysz temperaturę, gęstość cieczy zmniejszy się (§ 198), a ciśnienie i gęstość pary nasyconej wzrosną. W tabeli Rycina 22 pokazuje wartości gęstości wody i nasyconej pary wodnej dla różnych temperatur (a zatem dla odpowiednich ciśnień). Na ryc. 497 te same dane przedstawiono w formie wykresu. Górna część wykresu przedstawia zmianę gęstości cieczy w zależności od jej temperatury. Wraz ze wzrostem temperatury gęstość cieczy maleje. Dolna część wykresu przedstawia zależność gęstości pary nasyconej od temperatury. Zwiększa się gęstość pary. W temperaturze odpowiadającej punktowi gęstości cieczy i pary nasyconej pokrywają się.

Ryż. 497. Zależność gęstości wody i jej pary nasyconej od temperatury
Tabela 22. Właściwości wody i jej pary nasyconej w temp różne temperatury
|
Temperatura, |
Prężność pary nasyconej, |
Gęstość wody, |
Gęstość pary nasyconej, |
Ciepło właściwe parowania, |
Z tabeli wynika, że im wyższa temperatura, tym mniejsza różnica między gęstością cieczy a gęstością jej pary nasyconej. W pewnej temperaturze (w wodzie) gęstości te pokrywają się. Temperatura, w której gęstość cieczy i jej pary nasyconej pokrywają się, nazywana jest temperaturą krytyczną substancji. Na ryc. 497 odpowiada kropce. Ciśnienie odpowiadające punktowi nazywa się ciśnieniem krytycznym. Temperatury krytyczne różnych substancji znacznie się od siebie różnią. Niektóre z nich podano w tabeli. 23.
Tabela 23. Temperatura krytyczna i ciśnienie krytyczne niektórych substancji
|
Substancja |
Krytyczna temperatura |
Ciśnienie krytyczne, atm |
Substancja |
Krytyczna temperatura |
Ciśnienie krytyczne, atm |
|
Dwutlenek węgla |
|||||
|
Tlen |
|||||
|
Etanol |
|||||
O czym świadczy istnienie temperatury krytycznej? Co dzieje się w jeszcze wyższych temperaturach?
Doświadczenie pokazuje, że w temperaturach wyższych od krytycznych substancja może znajdować się tylko w stanie gazowym. Jeśli zmniejszymy objętość zajmowaną przez parę w temperaturze powyżej temperatury krytycznej, wówczas ciśnienie pary wzrośnie, ale nie ulegnie ona nasyceniu i nadal pozostanie jednorodna: niezależnie od tego, jak wysokie będzie ciśnienie, nie znajdziemy oddzielonych dwóch stanów przez ostrą granicę, jak to zawsze obserwuje się w przypadku większej liczby niskie temperatury na skutek kondensacji pary. Jeśli więc temperatura substancji jest wyższa od temperatury krytycznej, wówczas równowaga substancji w postaci cieczy i kontaktującej się z nią pary nie jest możliwa przy żadnym ciśnieniu.
Stan krytyczny substancji można zaobserwować za pomocą urządzenia pokazanego na rys. 498. Składa się z żelaznej skrzynki z okienkami, którą można wyżej ogrzać („łaźnia powietrzna”) oraz szklanej ampułki z eterem umieszczonej wewnątrz wanny. Po podgrzaniu kąpieli menisk w ampułce podnosi się, staje się bardziej płaski i ostatecznie zanika, co świadczy o przejściu przez stan krytyczny. W miarę ochładzania się kąpieli ampułka nagle staje się mętna w wyniku tworzenia się wielu drobnych kropelek eteru, po czym eter gromadzi się na dnie ampułki.

Ryż. 498. Urządzenie do obserwacji stanu krytycznego eteru
Jak widać z tabeli. 22, w miarę zbliżania się do punktu krytycznego, ciepło właściwe parowania staje się coraz mniejsze. Wyjaśnia to fakt, że wraz ze wzrostem temperatury różnica energii wewnętrznych substancji w stanie ciekłym i parowym maleje. W rzeczywistości siły adhezji cząsteczek zależą od odległości między cząsteczkami. Jeśli gęstości cieczy i pary różnią się nieznacznie, to średnie odległości między cząsteczkami niewiele się różnią. W związku z tym wartości energii potencjalnej interakcji między cząsteczkami będą się nieznacznie różnić. Drugi człon ciepła parowania – praca pod ciśnieniem zewnętrznym – również maleje w miarę zbliżania się do temperatury krytycznej. Wynika to z faktu, że im mniejsza jest różnica gęstości pary i cieczy, tym mniejsza ekspansja zachodząca podczas parowania, a co za tym idzie, mniejsza praca wykonana podczas parowania.
Na istnienie temperatury krytycznej po raz pierwszy wskazano w 1860 r. Dmitrij Iwanowicz Mendelejew (1834-1907), rosyjski chemik, który odkrył podstawowe prawa współczesnej chemii - prawo okresowe pierwiastki chemiczne. Wielkie osiągnięcia w badaniu temperatury krytycznej należą do angielskiego chemika Thomasa Andrewsa, który przeprowadził szczegółowe badania zachowania dwutlenku węgla podczas izotermicznej zmiany zajmowanej przez niego objętości. Andrews wykazał, że w niższych temperaturach w naczyniu zamkniętym możliwe jest współistnienie dwutlenku węgla w stanie ciekłym i gazowym; w wyższych temperaturach taka współistnienie jest niemożliwa i całe naczynie wypełnione jest wyłącznie gazem, niezależnie od tego, jak bardzo zmniejszy się jego objętość.
Po odkryciu temperatury krytycznej stało się jasne, dlaczego przez długi czas gazów takich jak tlen czy wodór nie można było przekształcić w ciecz. Ich temperatura krytyczna jest bardzo niska (tab. 23). Aby zamienić te gazy w ciecz, należy je schłodzić poniżej temperatury krytycznej. Bez tego wszelkie próby ich upłynnienia są skazane na niepowodzenie.
- W kontakcie z 0
- Google+ 0
- OK 0
- Facebook 0