Вещества по интенсивности окраски растворов (более точно - по поглощению света растворами).
Основные сведения
Один из первых колориметров, созданный французским оптиком Жюлем Дюбоском, 1880.
Колориметрия - это метод количественного определения содержания веществ в растворах , либо визуально , либо с помощью приборов, таких как колориметры .
Колориметрия может быть использована для количественного определения всех тех веществ, которые дают окрашенные растворы, или могут быть, с помощью химической реакции, дать окрашенное растворимое соединение. Колориметрические методы основываются на сравнении интенсивности окраски исследуемого раствора, изучаемого в пропущенном свете , с окраской эталонного раствора, содержащего строго определенное количество этого же окрашенного вещества, или же с дистиллированной водой.
Любопытна история возникновения колориметрии и фотометрии. Ю. А. Золотов упоминает, что Роберт Бойль (так же, как и некоторые ученые до него) использовал экстракт дубильных орешков, чтобы различить железо и медь в растворе. Однако, по-видимому, именно Бойль впервые заметил, что чем больше железа содержится в растворе, тем более интенсивна окраска последнего. Это был первый шаг к колориметрии. А первым инструментом колориметрии стали колориметры типа колориметра Дюбоска (1870) , которые использовались вплоть до недавнего времени .
Фотоколориметры и спектрофотометры измеряют величину пропускания света при определенной длине волны света. Контроль (обычно дистиллированная вода или исходный материал без добавления реагентов) используется для калибровки устройства.
Колориметрия широко применяется в аналитической химии, в том числе для гидрохимического анализа, в частности - для количественного анализа содержания биогенных веществ в природных водах, для измерения , в медицине, а также в промышленности при контроле качества продукции.
Фотоколориметрия
Фотоколориметрия - количественное определение концентрации вещества по поглощению света в видимой и ближней ультрафиолетовой области спектра. Поглощение света измеряют на фотоколориметрах или спектрофотометрах .
Примечания
Wikimedia Foundation . 2010 .
Смотреть что такое "Колориметрия (химический метод)" в других словарях:
Не следует путать с калориметрия. Колориметрия (от лат. color цвет и греч. μετρεω измеряю): Колориметрия (наука) наука об измерении цвета. Колориметрия (химический метод) метод химического анализа … Википедия
Изучает зависимости между составом и св вами макроскопич. систем, составленных из неск. исходных в в (компонентов). Для Ф. х. а. характерно представление этих зависимостей графически, в виде диаграммы состав свойство; применяют также таблицы… … Химическая энциклопедия
Содержание … Википедия
У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
В Викисловаре есть статья «органическая химия» Органическая химия раздел химии, изучающий со … Википедия
У этого термина существуют и другие значения, см. Биохимия (значения). Биохимия (биологическая, или физиологическая химия) наука о химическом составе живых клеток и организмов и о химических процессах, лежащих в основе их жизнедеятельности.… … Википедия
- (от др. греч. γῆ «Земля» и от λόγος «учение») наука о составе, строении и закономерностях развития Земли, других планет Солнечной системы и их естественных спутников. Содержание 1 История геологии … Википедия
Социальная работа профессиональная деятельность по организации помощи и взаимопомощи людям и группам, попавшим в трудные жизненные ситуации, их психосоциальной реабилитации и интеграции. В самом общем виде социальная работа представляет… … Википедия
Общие термины - Термины рубрики: Общие термины Абсолютно чёрное тело Абсолютный минимум Абсолютный показатель ресурсоиспользования и ресурсосбережения … Энциклопедия терминов, определений и пояснений строительных материалов
Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей. Квантовая химия это направл … Википедия
Колориметрия - один из наиболее простых методов абсорбционного анализа. Он основан на изменении оттенков цвета исследуемого раствора в зависимости от концентрации. Колориметрические методы можно разделить на визуальную колориметрию и фотоколориметрию.
Визуальная колориметрия
Она осуществляется за счет стандартных серий. Для этого исследуемый раствор сравнивают с набором стандартных растворов, которые должны быть свежеприготовленными и отличаться друг от друга не менее чем на 10-15 %.
Например, колориметрическое определение pH по Алямовскому основано на свойстве индикаторов изменять свою окраску в зависимости от концентрации ионов водорода, присутствующих в растворе.
Шкала прибора Алямовского представляет собой ряд запаянных пробирок, заполненных окрашенным раствором. Этот устойчивый к действию света раствор имитирует окраску универсального индикатора при определенном значении pH. Испытуемый раствор сравнивают со шкалой и находят в ней пробирку, наиболее совпадающую с ним по цвету. Если окраска жидкости не соответствует цвету растворов шкалы, то берут среднее значение между двумя приближающимися по цвету пробирками. Иногда может встретиться набор Алямовского, в котором стандартная цветная шкала представлена не ампулами с растворами, а стеклянными пластинками с цветными пленками.
Для удобства сравнения к прибору прилагается компаратор, но техника сравнения растворов со шкалой в этом случае другая. Пробирку с окрашенным испытуемым раствором нужно поместить в левое гнездо компаратора. В пробирку из правого гнезда компаратора наливают 5 мл дистиллированной воды. В пазы компаратора вставляют стандартную цветную шкалу, при этом ее окрашенная часть должна находиться против пробирки с дистиллированной водой, а бесцветная - против испытуемого раствора. Компаратор берут левой рукой и поднимают до уровня глаз, держа шкалой от себя и повернув ее к свету. Передвигая стандартную шкалу вверх и вниз, находят ту ее часть, которая по окраске совпадает с испытуемым раствором. Повернув компаратор шкалой к себе, отсчитывают значение pH и записывают результат анализа.
Фотоколориметрия
Фотоколориметрические методы - одна из широко используемых разновидностей абсорбционного оптического анализа. Для более точного определения анализируемого элемента применяют специальные приборы - фотоэлектроколориметры (ФЭК).
При работе на ФЭК чаше всего используют метод градуировочной кривой, основанный на построении калибровочного графика в осях «оптическая плотность - концентрация» для стандартных растворов известной концентрации. Измерив оптическую плотность анализируемого раствора, по графику находят его концентрацию. Для лучшего усвоения фотоколориметрического метода студентам предлагается провести лабораторный анализ определения ионов меди и никеля в растворе этим методом на КФК-3-01.
Лабораторная работа 1
ОПРЕДЕЛЕНИЕ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ В РАСТВОРЕ ФОТОКОЛОРИМЕТРИЧЕСКИМ МЕТОДОМ
Цель работы: научится работать на фотоколориметре КФК-3-01. Определить содержание ионов тяжелых металлов на КФК-3-01.
Порядок работы на фотометре КФК-3-01.
Закрыть крышку кюветного отделения. Включить тумблер «Сеть». По истечении 30 мин приступить к работе. Установить необходимую длину волны.
- 1. Установку длин волн необходимо выполнять подводкой со стороны коротких длин волн к более длинным. Если при установке значение длины волны превысило требуемое, необходимо вновь вернуться на 20-30 Нм к более коротким волнам и повторно подвести к требуемому значению.
- 2. Взять две кюветы. В одну налить дистиллированную воду, а в другую - исследуемый раствор. Кюветы заполняются до метки с боковой стороны. На наружной поверхности кюветы не должно быть капель.
- 3. Установить кюветы в кюветное отделение. Кювету с «холостой пробой» установить в дальнее гнездо кюветодержателя. Ручку перемещения кювет установить в крайнее левое положение. Закрыть крышку кюветного отделения.
- 4. Клавишей «Д» или «С» выбрать режим измерения. Нажать клавишу «#». На нижнем индикаторе, на верхней строке будет надписано «Градуировка» через 3-5 с. Надпись исчезнет и появится «Изменение», а на нижней строке - результат измерения. Ручку перемещения кювет установить вправо. На нижней строке появится результат измерения (оптическая плотность исследуемого раствора).
Задание 1. Определения содержания Си++ в растворе фотоколори-метрическим методом.
Оборудование и реактивы: фотометр КФК-3-01, кювета 3 см, колбы мерные емкостью 50 мл, пипетки 5,10 мл, стандартный раствор Си ++ - 0,5 мг/мл, раствор аммиака 1:1.
Методика эксперимента
1. Выбор длины волны.
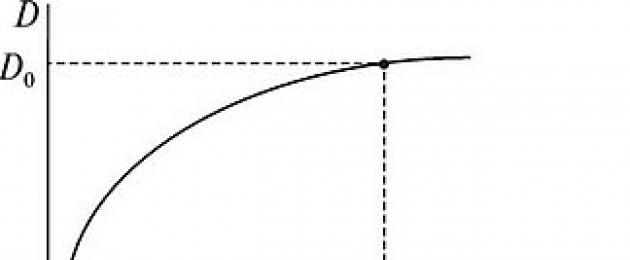
В мерную колбу емкостью 50 мл внести 14 мл стандартного раствора Си +2 , добавить 15 мл аммиака и довести водой до метки. Перемешать и замерить оптическую плотность раствора /) от длины волны X. Заполнить табл. 1. В качестве оптимальной принимается та длина волны Х 0 , при которой величина оптической плотности максимальна для данного раствора (рис. 1).
Рис. 1. Зависимость оптической плотности Э от длины волны X
2.
В мерных колбах емкостью 50 мл приготовить 5-6 растворов Си - ^ с различным содержанием от 1 до 7 мг/мл. Объем каждого раствора 15 мл. В каждую колбу добавить 15 мл аммиака и довести водой до метки. Перемешать и замерить оптическую плотность И при выбранной длине волны Х 0 . Заполнить табл. 2 и построить график зависимости оптической плотности?) от концентрации раствора С (рис. 2).

3. Определение содержания Си +2 в контрольном растворе.
В колбу с контрольным раствором добавить 10 мл воды, 15 мл аммиака. Водой довести до метки и перемешать. Замерить оптическую плотность раствора. По калибровочному графику (рис. 2) определить С 0 - содержание Си +2 в растворе.
4. Сделать выводы по работе.
Задание 2. Определение содержания №+2 в растворе фотоколори-метрическим методом.
Оборудование и реактивы: фотометр КФК-3-01, кювета 3 см, колбы мерные емкостью 50 мл, пипетки 5,10 мл, стандартный раствор 1Ч1 ++ - 0,01 мг/ мл, 1%-ный спиртовой раствор диметилглиоксима, йодная вода, раствор аммиака 1:1.
Методика эксперимента
1. Выбор длины волны.
В мерную колбу емкостью 50 мл внести 10 мл стандартного раствора № , добавить 5 мл йодной воды, 6 мл аммиака и 2 мл диметилглиоксима. Довести водой до метки, перемешать. Через 5-7 мин замерить оптическую плотность раствора при различных длинах волн. Заполнить табл. 1. Построить график зависимости оптической плотности раствора?> от длины волны X. В качестве оптимальной принимается та длина волны 7. 0 , при которой величина оптической плотности максимальна для данного раствора (см. рис. 1).
2. Построение калибровочного графика.
В мерных колбах емкостью 50 мл приготовить 5-6 растворов № +2 с различным содержанием от 0,01 до 0,1 мг/мл. Объем каждого раствора 10 мл. Затем в каждую колбу добавить реактивы, как указано в п. 1. Довести водой до метки, перемешать. Через 5-7 мин замерить оптическую плотность раствора при выбранной длине волны. Заполнить табл. 2 и построить график зависимости оптической плотности О от концентрации раствора С (см. рис. 2).
3. Определение содержания № +2 в контрольном растворе.
В колбу с контрольным раствором добавить 10 мл воды, а затем добавить реактивы, как указано в п. 1. Замерить /) 0 - оптическую плотность раствора. По калибровочному графику (рис. 3) С () определить С 0 - содержание № +2 в растворе.
4. Сделать выводы по работе.
Таблица 1
(Филин В.А. Видеоэкология. Что для глаза хорошо, а что - плохо. М.: Видеоэкология, 1997).
Методы анализа, основанные на сравнении интенсивности окрасок исследуемого раствора и раствора определенной концентрации - стандартного, называются колориметрическими (колориметрией). Различают визуальную колориметрию, осуществляемую при помощи глаза наблюдателя, и фотоэлектрическую колориметрию, осуществляемую при помощи фотоэлемента.
Если пропустить через слой раствора пучок света с интенсивностью I0, то после прохождения через этот слой интенсивность света уменьшится до It. Уравнение основного закона колориметрии - закона Бугера-Ламберта-Беера - имеет следующий вид:
![]()
где It - интенсивность светового потока после прохождения через раствор концентрацией С и толщиной слоя l; I0 - интенсивность падающего светового потока; g - коэффициент, зависящий от длины волны падающего света, природы растворенного вещества и температуры раствора; коэффициент g называют молярным коэффициентом погашения. Отношение интенсивности светового потока, прошедшего через раствор It к интенсивности падающего светового потока I0 называется пропусканием, или прозрачностью, и обозначается буквой T:

Величина Т, отнесенная к толщине слоя в 1 см, называется коэффициентом пропускания. Логарифм величины, обратной пропусканию, носит название погашения (экстинции) Е, или оптической плотности D:

Следовательно, погашение Е прямо пропорционально концентрации вещества в растворе. Если графически изобразить зависимость погашения от концентрации, откладывая по оси абсцисс концентрацию, а по оси ординат - погашение, то получим прямую линию, идущую от начала координат (рис. 52).

Такой график дает возможность сделать заключение о применимости к исследуемым растворам основного закона колориметрии. Если раствор подчиняется этому закону, то график, выражающий зависимость погашения; от концентрации, будет представлен прямой линией. Если раствор этому закону не подчиняется, то прямолинейность нарушается на каком-то участке кривой или на всей ее длине.
Методы визуальной колориметрии
Визуальная колориметрия осуществляется по одному из следующих методов: 1) метод стандартных серий; 2) метод колориметрического титрования или дублирования; 3) метод уравнивания окраски. Первые два из них не требуют соблюдения основного закона колориметрии; метод уравнивания окрасок требует подчинения растворов основному закону колориметрии.

Метод стандартных серий
Сущность метода. При колориметрировании по методу стандартных серий исследуемый раствор в слое определенной толщины сравнивают с набором стандартных растворов такой же толщины слоя, отличающихся один от другого по интенсивности окраски примерно на 10-15%. Неизвестная концентрация равна концентрации стандартного раствора, окраска которого совпадает с окраской исследуемого раствора или находится между двумя ближайшими более слабо или более сильно окрашенными. Методом стандартных серий можно пользоваться для определения содержания в ректификованном спирте альдегидов, сивушного масла, метилового спирта. Окраску сравнивают в пробирках с притертыми пробками одинакового диаметра из бесцветного стекла одинаковой толщины. Колориметрические пробирки помещают в специальный штатив (рис. 53) и на фоне матового стекла или листа белой бумаги сравнивают окраску исследуемого раствора с окраской типовых растворов. При пользовании пробирками с плоским дном окраски можно сравнивать, рассматривая растворы сверху. Это особенно удобно при работе со слабоокрашенными растзорами.
1) типовые растворы изоамилового спирта с содержанием его 0,0005; 0,001; 0,002 и 0,003% об. в 96%-ном этиловом спирте, не содержащем сивушного масла и альдегидов;
2) 0,05%-ный раствор парадиметиламинобензальдегида в концентрированной х. ч. серной кислоте относительной плотностью 1,835.
Ход анализа. Отмеряют градуированной пипеткой на 1 мл 0,5 мл исследуемого спирта и помещают в чистую сухую плоскодонную колбу с длинным горлышком, куда прибавляют из измерительного цилиндра 10 мл раствора парадиметиламинобензальдегида. Содержимое перемешивают, колбу погружают в кипящую водяную баню и выдерживают при кипении воды ровно 20 мин. В качестве водяной бани применяют стеклянный химический стакан емкостью 300 мл. Горло колбы при кипячении должно быть в наклонном положении. По истечении 20 мин колбу быстро охлаждают в проточной воде. При этом содержимое колбы приобретает светло-желтоваторозовую окраску, переходящую в розовую различной интенсивности в зависимости от содержания сивушного масла.
Содержимое колбы переливают в пробирку с притертой пробкой. Окраску исследуемого спирта сравнивают с окраской типовых растворов, подвергнутых той же обработке, что и исследуемый спирт. По совпадению окрасок определяют содержание сивушного масла в исследуемом спирте.
Метод колориметрического титрования
В методе колориметрического титрования определенный объем исследуемого окрашенного раствора неизвестной концентрации сравнивают с таким же объемом воды, к которой добавляют окрашенный стандартный раствор определенной концентрации. Добавляют раствор из бюретки (титруют) до уравнивания окраски с исследуемым раствором. В технохимическом контроле бродильных производств этот метод применяют для определения цветности пива, которую выражают в миллилитрах 0,1 н. раствора йода, добавленных к 100 мл дистиллированной воды для уравнивания окраски со 100 мл пива. Ход работы. Определение это проводят следующим образом. Два одинаковых химических стакана емкостью 150-200 мл ставят на лист белой бумаги или на белую фарфоровую пластинку. В один наливают 100 мл пива, в другой - 100 мл дистиллированной воды. В стакан с водой приливают из бюретки при помешивании 0,1 н. раствор йода до тех пор, пока цвет жидкостей не станет одинаковым при рассматривании как сверху, так и сбоку (через жидкость).
Метод уравнивания окраски
Представим себе, что имеются два окрашенных раствора, содержащих одно и то же окрашенное вещество, но в разных концентрациях. Погашение каждого из растворов будет соответственно равно
Изменяя толщину слоя этих растворов (l), можно добиться такого состояния, при котором, несмотря на различные концентрации, интенсивность светового потокa, прошедшего через оба раствора, будет одинакова - наступит оптическое равновесие. Это случится тогда, когда оба раствора будут поглощать одну и ту же долю света, т.е. когда погашения растворов будут равны; при этом Е1 = Е2 и eC1l1 = еС2l2. Коэффициент погашения е обоих растворов один и тот же (в растворе содержится одно и то же вещество). Следовательно,
![]()

т.е. толщины слоев растворов при одинаковой наблюдаемой окраске обратно пропорциональны концентрациям растворов. Эта зависимость между толщиной слоя и концентрацией лежит в основе метода уравнивания окраски.

Уравнивание окрасок проводят в специальных приборах - колориметрах. Весьма распространенным является колориметр погружения системы Дюбоска. Оптическая схема этого колориметра такова (рис. 54). Световой поток от зеркала 1 проходит через слой исследуемого раствора в кювете 2, погружатель 4, призму 6, линзы 8 и 9 и попадает в окуляр, освещая правую половину оптического поля. Другой световой поток проходит через слой стандартного раствора в кювете 3, погружатель 5, призму 7, линзы 8 и 9 и попадает в окуляр, освещая левую половину оптического поля. Изменяя с помощью кремальер высоты столбов растворов, добиваются оптического равновесия - исчезновения границы раздела. Общий вид колориметра показан на рис. 55.

Цветность ликеро-водочных изделий определяют цветомером, представляющим собой колориметр погружения типа Дюбоска у которого одна из кювет заменена рамкой, на которую помещается соответствующий сухой цветной эталон. Твердые цветные эталоны - это ацетатная пленка, окрашенная стойкими химическими красителями.
Для измерения цветности исследуемого изделия его после фильтрации наливают в кювету 1 цветомера (рис. 56), а на специальную подставку кладут соответствующий эталон 2. Лучи света, пройдя кювету с исследуемым раствором и цветной эталон, поступают через призмы 3 и 4 в камеру 5 с двумя призмами, которые направляют лучи света в зрительную трубу 6. В зрительной трубе наблюдают поле, одна половина которого освещена лучом, проходящим через исследуемое изделие. Равномерной окраски обоих сегментов поля достигают поднятием или опусканием кюветы 1 при помощи кремальеры.
После уравнивания окраски в обоих сегментах поля зрения по шкале прибора отсчитывают высоту столба жидкости в миллиметрах и сравнивают ее с высотой столба, утвержденной для заданного изделия. Так, для апельсинового ликера применяют эталон №7, высота столба по шкале цветомера должна составлять 33 мм, для шоколадного ликера - эталон №14, высота столба 26 мм. Указанные данные для всех ликеро-наливочных изделий приведены в инструкции по технохимическому контролю ликеро-водочного производства. Если полученные цифры равны или разнятся между собой на ±5, то считают, что цвет исследуемого изделия соответствует утвержденному образцу. Если полученная высота больше утвержденной, изделие недокрашено, если меньше, то перекрашено.
В наборе эталонов имеются бесцветные светофильтры-компенсаторы, которые служат для уравнения натуральной яркости цветов некоторых изделий с яркостью окраски цветного светофильтра. Компенсатор накладывают на световое отверстие цветомера под кювету с изделием.
Фотоколориметрический метод
Данный метод описан в главе книги "Технохимический контроль овощесушильного и пищеконцентратного производства".
Колориметрическое определение содержания углеводов в полупродуктах спиртового производства (метод ВНИИСЛа)
Реактивом для определения содержания углеводов колориметрическим методом в полупродуктах спиртового производства является раствор антрона в х. ч. серной кислоте относительной плотностью 1,830 (концентрацией 0,2% мас.). В сильно кислой среде глюкоза разлагается с образованием фурфурольных производных, которые реагируют с антроном, образуя комплексное соединение зеленого цвета. Указанным методом определяют суммарное количество углеводов, и данные получают в единицах глюкозы. Проводить предварительный гидролиз полисахаридов в глюкозу не требуется, так как реакция с антроном протекает в сильно кислой среде; при этом полисахариды гидролизуются до моносахаридов, которые и реагируют с антроном.

Для определения содержания углеводов необходимо построить градуировочную кривую на растворах х. ч. глюкозы концентрацией 5-10 мг/100 мл (рис. 59). Градуировочную кривую строят следующим образом. Готовят растворы х. ч. глюкозы концентрацией от 5 до 10 мг в 100 мл раствора через каждый миллиграмм. Затем в пробирку из тугоплавкого стекла емкостью 20 мл наливают 5 мл реактива и осторожно добавляют туда 2,5 мл приготовленного раствора глюкозы так, чтобы образовалось два слоя. Пробирку закрывают притертой пробкой, содержимое ее быстро перемешивают и помещают пробирку в кипящую водяную баню на 6 мин. По истечении этого времени пробирку вынимают из бани, реакционную смесь охлаждают до 20° С и окрашенный раствор колориметрируют в фотоколориметре с применением светофильтра с длиной световой волны 610 нм и кюветы с длиной грани 5 мм. Измерения начинают с наиболее концентрированного раствора (в данном примере 10 мг глюкозы в 100 мл раствора). Оптическую плотность измеряют с помощью левого барабана. Измерив оптическую плотность всех растворов, строят градуировочную кривую, откладывая по оси абсцисс известные концентрации, а по оси ординат - соответствующие им оптические плотности. Как видно из приведенной кривой (см. рис. 59), оптическая плотность увеличивается пропорционально концентрации глюкозы в растворе. Эта зависимость выражается прямой линией.
Для определения углеводов исследуемый раствор разбавляют до содержания их 5-10 мг в 100 мл раствора и проводят определение таким образом: в пробирку наливают 5 мл реакционной смеси, затем осторожно добавляют 2,5 мл исследуемого раствора так, чтобы образовались два слоя. В дальнейшем поступают, как и при построении градуировочной кривой. Определив оптическую плотность D по градуировочной прямой находят содержание глюкозы в растворе. Содержание глюкозы в растворе можно также подсчитать по уравнению
![]()
которое является уравнением градуировочной прямой и составлено по координатам этой прямой.
Обычно оптическую плотность определяют в кювете с длиной грани 5 мм. Если же раствор глюкозы будет очень концентрированным, то после реакции с антроном получится слишком интенсивно окрашенный раствор, оптическая плотность которого будет больше предельной оптической плотности барабана фотоколориметра и нельзя будет определить ее значение; при сильно разбавленном растворе глюкозы значение оптической плотности будет мало и ошибка определения значительна. В обоих случаях следует повторить анализ, изменив соответствующим образом разведение раствора. Можно также, не повторяя анализа, определить оптическую плотность, применив при колориметрировании другую кювету: для сильно окрашенных растворов с длиной грани 3 или 1 мм, для слабоокрашенных - 10 или 20 мм. Получив оптическую плотность в других кюветах, нельнельзя определять содержание глюкозы по градуировочной прямой, составленной применительно к кювете с длиной грани 5 мм. Необходимо предварительно подсчитать величину оптической плотности раствора, которая получается при этой длине грани кюветы по уравнению

где D5 - оптическая плотность раствора, полученная с применением кюветы с длиной грани 5 мм; Dx - оптическая плотность раствора, полученная в кювете с длиной грани а мм.
Указанный метод применим для растворов, содержащих глюкозные остатки, в которых отсутствуют пентозы и пентозаны.
Определение содержания растворимых несброженных углеводов в зерно-картофельной зрелой бражке (метод ВНИИСЛа)
В зерно-картофельной зрелой бражке наряду с углеводами, которые могут быть превращены в спирт (крахмалом, декстринами, мальтозой, глюкозой), содержатся также пентозы и пентозаны, которые в спирт не превращаются. При определении химическим методом находят общее количество углеводов. Между тем очень важно знать содержание в бражке сбраживаемых углеводов, которые могли сбродить, но не сбродили из-за неполного осахаривания и брожения, - так называемых несброженных углеводов. До последнего времени их определяли по разности между общим количеством углеводов и пентоз; определение пентоз (см. стр. 82) сравнительно сложно и длительно. Колориметрический анализ дает возможность провести прямое определение несброженных углеводов в бражке.
Известно, что антрон дает окрашивание со всеми углеводами, в том числе и с пентозами. Однако антроновая реакция примерно в 12 раз менее чувствительна при определении пентоз, чем при анализе гексоз. ВНИИСЛ разработал новую модификацию антронового метода, в которой устранено влияние пентоз и пентозанов на результаты анализа. Эта модификация основана на следующем законе колориметрии: оптическая плотность смеси компонентов равна сумме произведений коэффициентов погашения отдельных компонентов на их концентрацию
где D - оптическая плотность смеси, равная lg0/l. Здесь l0 - интенсивность исходного света; l - интенсивность света, прошедшего через раствор; e1, e2, ..., en - коэффициенты погашения;
Здесь D - оптическая плотность компонента, С - концентрация компонента в растворе, l - длина грани кюветы.
Оптическая плотность раствора зависит от длины волны. При разработке метода были подобраны две волны. При одной из них первый компонент (глюкоза) имеет интенсивную полосу, а второй (арабиноза) поглощает лишь очень слабо. При другой длине волны должна быть обратная картина. На основании проведенных исследований были выбраны для колориметрирования светофильтры с длиной световой волны 610 и 413 нм.
Определение содержания несброженных углеводов в бражке проводят следующим образом. Взвешивают навеску 25 г фильтрата бражки в стаканчике, переносят ее в мерную колбу емкостью 200 мл. Стаканчик ополаскивают водой и промывные воды сливают в ту же колбу. Затем в колбу добавляют для осветления 2 мл 30%-ного раствора сернокислого цинка, перемешивают, выдерживают 2-3 мин и добавляют 2 мл 15%-ного раствора желтой кровяной соли и снова перемешивают. Объем раствора доводят дистиллированной водой до метки.
Раствор фильтруют в сухую колбу. Первые 20-30 мл фильтрата выливают, а последующие порции используют для анализа. Фильтрат вторично разбавляют с таким расчетом, чтобы в 100 мл раствора содержалось углеводов от 5 до 12 мг. Для определения в пробирку емкостью 20 мл с притертой пробкой наливают 10 мл антронового реактива и осторожно добавляют 5 мл исследуемого раствора таким образом, чтобы жидкости не смешивались, а получилось два слоя; пробирку закрывают притертой пробкой. Параллельно готовят холостой раствор, добавляя к 10 мл реактива 5 мл дистиллированной воды. Содержимое пробирок энергично перемешивают в течение 10 сек и погружают в бурно кипящую водяную баню. Кипение должно возобновиться в течение 0,5 мин с момента погружения пробирок в баню. Замечают начало кипения воды в бане и выдерживают 5,5 мин для проведения реакции. После выдерживания пробирки охлаждают в бане с проточной водой до 20° С. Определяют оптическую плотность полученного раствора на левом барабане фотоэлекгроколориметра с применением двух светофильтров: оранжевого с длиной волны Л=610 нм и синефиолетового с Л=413 нм в кювете с длиной грани 5 мм. Кювету ополаскивают 2-3 раза исследуемым раствором, затем заполняют ее так, чтобы жидкость не доходила до краев на 5 мм. Внешние стенки кюветы обмывают струей воды и вытирают сухой фильтровальной бумагой. Таким же образом наливают холостой раствор в две другие кюветы такого же размена и проводят определение оптической плотности.
По значениям оптической плотности находят содержание растворимых несброженных углеводов по уравнениям:

Где D1 - оптическая плотность при светофильтре с длиной волны Л = 610 нм; D2 - оптическая плотность при светофильтре с длиной волны Л = 413 нм; n - коэффициент разведения.
Краткие теоретические сведения.Колориметрические методы основаны на визуальной оценке поглощения света растворами. Колориметрический анализ – небольшая составная часть спектрофотометрического анализа. Простейшие колориметрические методики появились еще в XIX веке (например, методики анализа минеральных вод), но и сегодня в агрохимическом, гидрохимическом и клиническом анализе применяют экспрессные методики, не требующие приборов и лабораторного оборудования. Колориметрические методы употребляют там, где экспрессность и низкая стоимость анализа важнее его точности. Отметим, что в современных колориметрических методиках применяют те же фотометрические реакции, что и при инструментальных методах измерения светопоглощения.
Для оценки концентрации определяемого вещества можно применять различные варианты колориметрического анализа.
1. Метод стандартной шкалы. Это самый распространенный и самый быстрый из всех колориметрических методов. В нем видимую окраску исследуемого раствора сопоставляют в одинаковых цилиндрах или пробирках с серией окрашенных растворов того же состава, но с известным содержанием определяемого вещества Х. Иногда вначале используют шкалус сильно отличающимися концентрациями (грубое определение), а затем, выяснив, между какими стандартными растворами оказалась концентрация Х в исследуемом растворе, готовят новую, более подробную шкалу именно для этого интервала концентраций и затем уточняют по ней результат анализа. Метод стандартной шкалы не требует выполнения закона Бера (в отличие от метода уравнивания) и дает погрешность порядка 30% отн.
Так как человеческий глаз значительно лучше отличает оттенки цветов, чем изменения в интенсивности одного и того же цвета, то метод стандартной шкалы дает лучшие результаты в тех случаях, когда растворы, образующие стандартную шкалу, отличаются по цвету. Например, органический реагент дитизон в отсутствие переходных металлов имеет чисто зеленую окраску, комплекс дитизона с цинком – красную, а растворы стандартной шкалы, содержащие разные количества цинка и одинаковое количество дитизона, взятого в избытке, дают все возможные промежуточные окраски между зеленой и красной. В подобных случаях определение концентрации металлов по стандартной шкале не уступает по точности многим инструментальным методам (погрешность порядка 10%).
2. Колориметрическое титрование. При таком «титровании» никаких химических реакций не происходит, название условно. Метод заключается в том, что из исследуемой пробы готовят окрашенный раствор и наливают его в некоторый сосуд, а в другой такой же сосуд с чистым растворителем понемногу добавляют стандартный окрашенный раствор Х с известной концентрацией (большей, чем в пробе) до тех пор, пока окраски растворов на глаз не сравняются. Поскольку толщина поглощающего слоя одинакова, считают, что после уравнивания окрасок концентрация Х в обоих растворах также одинакова. По затраченному объему стандартного раствора рассчитывают, сколько определяемого вещества содержалось в пробе.
3. Метод разбавления. В этом методе также готовят исследуемый и стандартный окрашенные растворы, а затем тот, что интенсивнее окрашен, разбавляют чистым растворителем до тех пор, пока (при одинаковой толщине слоя раствора!) их видимые окраски не сравняются. Зная степень разбавления, рассчитывают концентрацию исследуемого раствора.
4. Метод уравнивания. Одинаковой интенсивности поглощения света исследуемым и стандартным растворами здесь добиваются, изменяя толщину поглощающего слоя. Это можно сделать в специальном приборе – колориметре погружения или просто в паре цилиндров, если смотреть на них сверху. Если химический состав обоих растворов одинаков, закон Бера выполняется, а видимые окраски (а значит, и оптические плотности растворов) одинаковы, можно записать:
D ст = e l ст С ст D х = e l х С х С х = С ст l ст / l x
Метод уравнивания более точен, чем другие колориметрические методы, и позволяет найти концентрацию С х с погрешностью 10-20%.
В данной работе описаны методики анализа природных вод на содержание различных токсичных веществ, причем во всех случаях рекомендуется метод стандартной шкалы. Однако по указанию преподавателя анализ можно провести другим визуальным методом. Рассмотрим свойства некоторых токсичных веществ, которые можно определять в природных водах колориметрическим методом, а также реакции образования из них окрашенных соединений. Именно эти реакции необходимо будет проводить в ходе лабораторной работы.
Определение фенолов.Фенолы – ароматические соединения с одной или несколькими гидроксильными группами, непосредственно связанными с ароматическим ядром, например бензольным кольцом. Они попадают в окружающую среду из стоков промышленных предприятий, особенно коксохимических и нефтеперерабатывающих. Фенолы обладают сильным биологическим действием. При концентрации фенолов 0,50 мг/л в речной воде погибает рыба. В питьевой воде в РФ предельно допустимая концентрации фенолов установлена на уровне 0,001 мг/л (в пересчете на простейший фенол C 6 H 5 OH). Содержание фенолов в питьевой воде, природных и сточных водах контролируется лабораториями санитарной службы и других организаций. Для определения фенолов применяют различные способы перевода их в окрашенные соединения; выбор метода анализа зависит от концентрации фенола в исследуемой воде и наличия мешающих веществ. Иногда в ходе анализа сумму фенолов отделяют от нелетучих мешающих веществ, отгоняя фенолы из исследуемой пробы с водяным паром, в данной работе этого не требуется. Если концентрация фенолов ожидается на уровне 0,05-50 мг/л (сильно загрязненные воды), то анализ проводят по методу Грисса, используя реакцию с пара-нитроанилином. Этот реагент заранее (в день анализа) диазотируют нитритом натрия, а потом проводят реакцию азосочетания с фенолом:
2H + ® + 2H 2 O
Получившийся азокраситель имеет интенсивную желто-бурую окраску. Концентрация красителя будет пропорциональна концентрации фенола в воде в том случае, если другие реагенты (нитрит, п-нитроанилин) взяты в большом и одинаковом избытке. Определение неселективно: разные фенолы дают близкие по свойствам окрашенные продукты. Выход продуктов сильно зависит от pH. Диазотирование ведут в кислой, а азосочетание – в щелочной среде.
При выполнении работы учтите, что фенолы и п-нитроанилин токсичны. Обращаться с осторожностью!
Определение нитритов.Наличие повышенной концентрации нитритов в природных водах свидетельствует о загрязнении их хозяйственными стоками. Содержание нитритов в природных водах колеблется от нескольких мкг до десятых долей мг в 1 л (нитриты менее токсичны, чем фенолы, ПДК – 1 мг/л). Для определения нитритов наиболее часто применяется колориметрический метод, основанный на реакции нитритов с сульфаниловой кислотой и a-нафтиламином (реакция Грисса-Илосвая). Вначале присутствующие нитриты реагируют с сульфаниловой кислотой (реакция диазотирования), затем диазотированная сульфаниловая кислота реагирует с a-нафтиламином (реакция азосочетания), при этом образуется красно-фиолетовый краситель:
Поскольку оба реагента вводят в большом избытке по сравнению с нитритами, то концентрация красителя и оптическая плотность его раствора зависят только от концентрации нитритов. Закон Бера, как правило, хорошо выполняется. Предел обнаружения нитритов без дополнительного концентрирования – 1 мг/л. Мешают сильные окислители и восстановители.
Определение хлора.Содержание «активного хлора» определяют в ходе анализа хлорированной водопроводной воды. Растворенный хлор определяют и в некоторых сточных водах, ПДК С l = 0,4 мг/л. Кроме молекул Cl 2 , в понятие «активного хлора» входят и ряд других неустойчивых соединений хлора, образующихся при хлорировании воды, например, гипохлориты, хлорамины и т. д. Все эти соединения реагируют подобно свободному хлору и определяются суммарно. Результат анализа выражают в пересчете на Сl 2 (мг/л). Определение должно быть проведено немедленно после отбора пробы воды.
Для определения небольших количеств хлора наиболее удобен колориметрический метод с о-толуидином. Этот реагент окисляется хлором (а также другими окислителями) по не вполне изученному механизму, при этом раствор приобретает желтую или оранжевую окраску. Определению мешают железо (>0,3 мг/л) и нитриты (>0,1 мг/л). В присутствии ряда мешающих веществ определение хлора серьезно усложняется. Соответствующие методики описаны в литературе.
Поскольку стандартная шкала, содержащая окисленный о-толуидин, неустойчива при хранении, а готовить ее ежедневно заново нежелательно, в лабораториях часто пользуются устойчивой искусственной шкалой, приготовленной из растворов K 2 CrO 4 и K 2 Cr 2 O 7 . Окраска стандартных растворов такой шкалы на глаз точно соответствует окраске растворов, содержащих различные известные количества продукта взаимодействия хлора с о-толуидином. Подобные искусственные шкалы в практике используют весьма часто.
Колориметрия как метод химического анализа применяется для определения концентрации определенного вещества в растворе. Метод позволяет работать с окрашенными растворами или растворами, которые можно сделать окрашенными в результате определенной химической реакции.
Основы колориметрии
Химические методы анализа с помощью колориметрии основаны на законе Бугера-Ламберта-Веера, который гласит, что интенсивность окраски зависит от концентрации окрашенного вещества в растворе и от толщины слоя жидкости.
С помощью различных методик колориметрии можно оценивать количественное содержание определенных веществ в растворе с достаточно высокой точностью - обычно она составляет 0,1-1 %. Эта точность, как правило, не уступает точности, с которой определяют концентрации в результате гораздо более сложных и дорогих химических анализов, и достаточна для многих задач - не только производственных, но и экспертного характера. Колориметрическими методами можно определять концентрации веществ вплоть до 10−8 моль/л.
Колориметрические методы используют визуальное сравнение или сравнение с помощью приборов - фотоколориметров или спектрофотометров. Сравнение производится прямым или компенсационным методами.
Прямой метод
 Прямой метод предусматривает сравнение степени окрашиваемости исследуемого раствора при определенной температуре и в определенном слое жидкости с эталонным раствором. Эталон содержит точно известное количество окрашивающего вещества при той же температуре и в том же слое жидкости.
Прямой метод предусматривает сравнение степени окрашиваемости исследуемого раствора при определенной температуре и в определенном слое жидкости с эталонным раствором. Эталон содержит точно известное количество окрашивающего вещества при той же температуре и в том же слое жидкости.
Иногда сравнение производится с дистиллированной водой. Как правило, подобные методы опираются на применение фотоколориметров или спектрофотометров. Эти приборы измеряют силу тока, зависящую от интенсивности излучаемого света, пропущенного через исследуемый раствор.
Точность аппаратного измерения выше, чем визуального. Применяют также визуальный метод сравнения интенсивности окраски раствора с эталонными растворами, концентрация вещества в которых известна.
Компенсационный метод
Компенсационный метод основан на доведении окраски исследуемого образца до эталонной. Растворы, с помощью различных оптических приспособлений - зеркал, стекол и призм помещают в приборе таким образом, чтобы они совмещались в поле зрения исследователя. Глаз способен с высокой точностью фиксировать одинаковость окраски двух образцов. В некоторых приборах задача облегчается тем, что при совпадении интенсивности окраски исчезает визуальная граница, первоначально разделяющая растворы.
Для того чтобы привести изучаемый раствор к эталонному, к нему добавляют прозрачный растворитель или увеличивают высоту слоя жидкости. Потом из значения величины добавленного разбавителя или высоты слоя раствора выводят количественную характеристику концентрации красящих веществ в растворе. Компенсационные методы применяются в визуальных колориметрах и в фотоколориметрах. Они наиболее практичны, так как на них не влияют посторонние факторы - например, температура.
Когда и где применяются колориметрические методы
Колориметрические методы для химического анализа применяются в тех случаях, когда точно известен химический состав раствора; раствор прозрачен; имеется эталонный образец; температуры образца и исследуемого раствора равны. С помощью этих методов удается определять концентрации веществ и в неокрашенных растворах, если есть возможность с помощью добавления определенного реактива сделать раствор окрашенным.
Колориметрия используется:
В аналитической химии;
- в медицине (содержание крови);
- для контроля качества питьевой воды и сточных вод;
- в пищепроме для определения степени очистки вина, пива, сахара;
- в промышленности - для анализа состава смазочных масел, керосина.
Достоинства колориметрических методов:
Простота;
- нет необходимости в дорогом оборудовании;
- оперативность измерений, возможность проведения анализов прямо на производстве;
- возможность определения очень малых концентраций веществ, которые другими методами химического анализа вычислить сложно.
В магазине лабораторной посуды и химического оборудования «ПраймКемикалсГрупп» вы можете по доступным ценам купить и колориметрические пробирки различного объема. Осуществляем доставку по Москве и Московской области.